Впервые раскрыта структура белков-шаперонов теплового шока
Ученые из Детской исследовательской больницы Св. Иуды впервые определили полные структуры двух белков-шаперонов теплового шока в комплексе. Исследование раскрывает ключевой механизм, регулирующий их функцию.
Шаперонный комплекс связывается с неправильно свернутыми белками и дает им еще один шанс свернуться корректно. Этот процесс жизненно важен для клеток, поскольку неправильно свернутые белки склонны к агрегации, что может вызывать различные заболевания.
«Белки-шапероны теплового шока образуют первую линию защиты от неправильного свертывания и агрегации белков — предшественника многих заболеваний», — заявил ведущий автор Харилампос Бабис Калодимос.
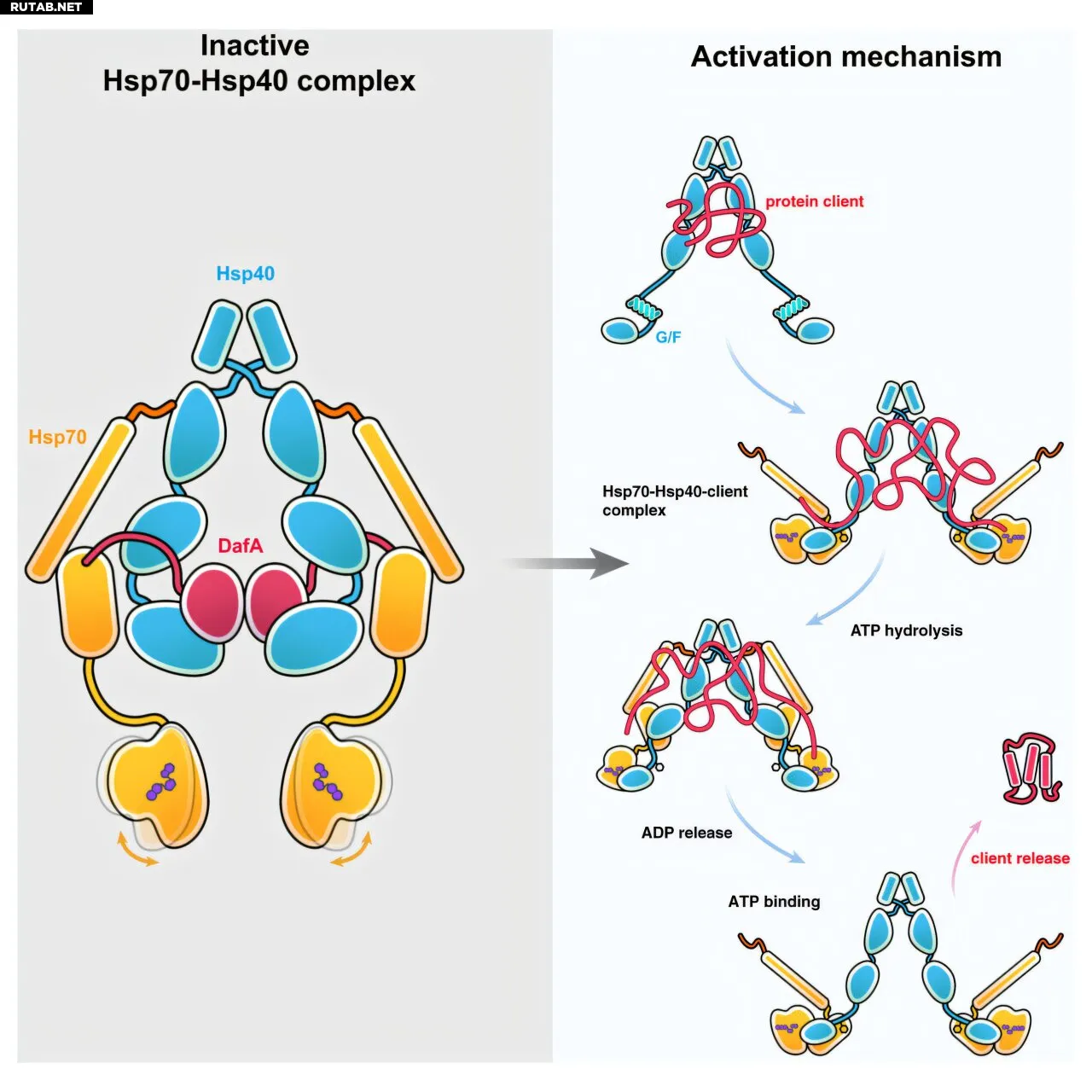
Вместо использования единого подхода ученые объединили данные криогенной электронной микроскопии, ядерного магнитного резонанса и рентгеновской кристаллографии, чтобы наконец решить структуру бактериального комплекса. Они захватили несколько форм структуры, состоящей из димеров Hsp70, взаимодействующих с димерами Hsp40, в различных состояниях связывания с белками-клиентами.
Структуры показали, что определенная область Hsp40 сначала связывается с белком-клиентом, затем конкретный фенилаланин связывается с сайтом связывания субстрата на Hsp70. Этот фенилаланин затем «втягивает» неправильно свернутый белок в сайт связывания субстрата, вытесняя себя, в то время как остальная часть Hsp40 остается связанной с Hsp70.
Ученые также обнаружили, что когда АТФ (энергетическая валюта клетки) связывается с Hsp70, белок меняет форму, выталкивая фенилаланин обратно в связывающий карман, что в свою очередь выталкивает белок-клиент и высвобождает его в клетку.
«Теперь мы механически понимаем, как шапероны и белок-клиент образуют этот очень большой комплекс, как они высвобождаются и как циклически проходят через эти состояния», — сказал Калодимос.
Исследование опубликовано в журнале Molecular Cell.











0 комментариев