Ученые раскрыли двойной механизм связывания белков с РНК
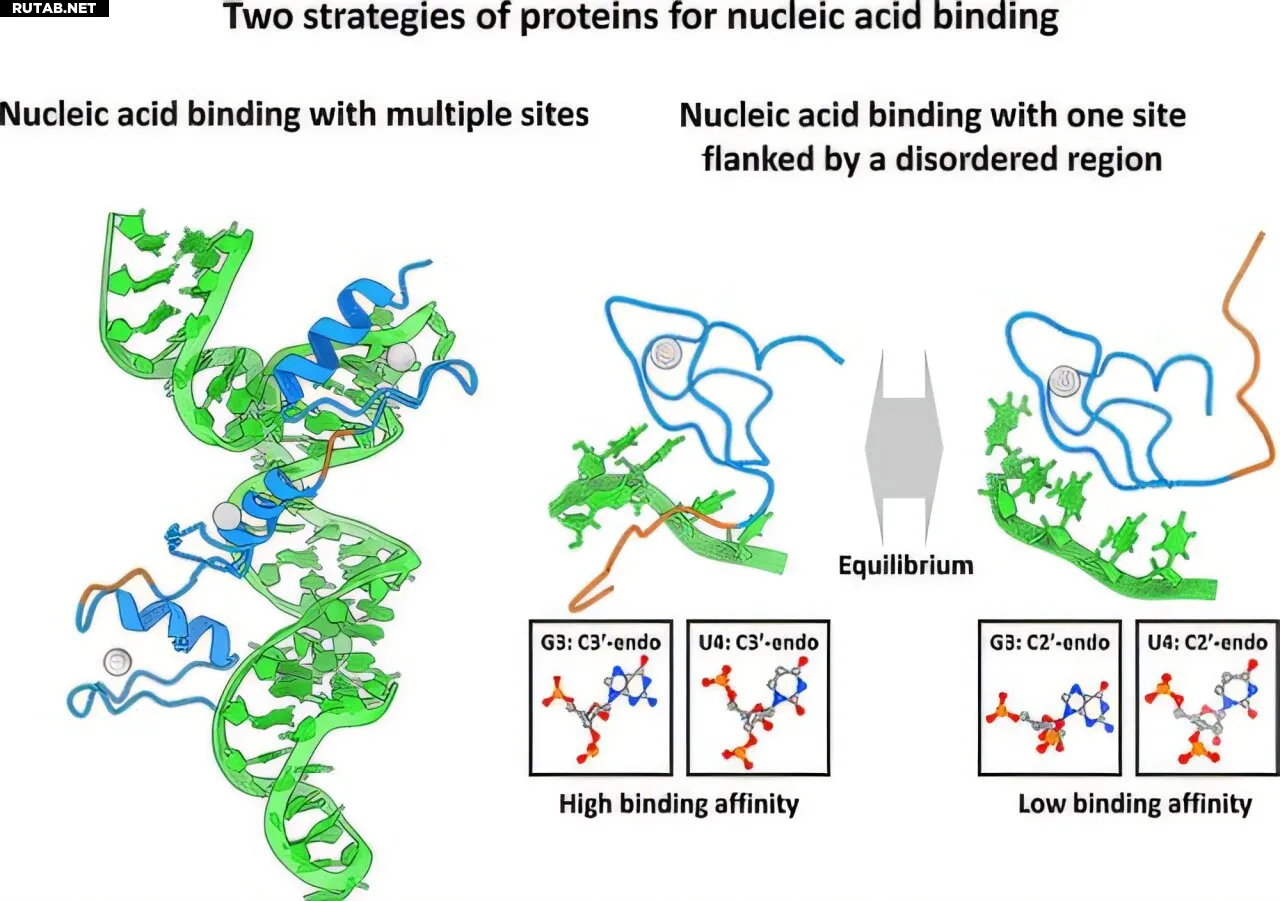
Графическая аннотация. Автор: Journal of Chemical Information and Modeling (2025). DOI: 10.1021/acs.jcim.5c01059
Исследователи из Токийского научного института (Япония) обнаружили двойной механизм связывания РНК-связывающих белков, который включает цинковые пальцы (ZnF) и внутренне неупорядоченные области (IDR).
С помощью передового молекулярного моделирования ученые проанализировали комплекс «белок FUS–РНК». Исследование показало, что белок использует свой домен ZnF для распознавания последовательности РНК, а гибкий домен IDR — для неспецифических взаимодействий.
Белок FUS (Fused in Sarcoma) хорошо известен своей ролью в регуляции генов и нейродегенеративных заболеваниях. Хотя его широко изучали, точный механизм связывания оставался плохо понятным.
Профессор Акио Китао и аспирант Соичиро Киидзима применили молекулярное моделирование для анализа взаимодействий между белком FUS и последовательностями РНК. Результаты опубликованы в Journal of Chemical Information and Modeling.
Исследователи выявили два различных режима связывания: один с участием только структурированной области ZnF и второй, более стабильный, где и домен ZnF, и неупорядоченная область взаимодействуют с цепью РНК.
«Мы наблюдали, что структурированный домен ZnF распознает специфические последовательности РНК, но сам по себе связывается лишь слабо. Неожиданно оказалось, что именно неупорядоченная IDR усиливает это взаимодействие», — поясняет Китао.
Неупорядоченная область IDR присоединяется к РНК неспецифическим образом через зарядовые взаимодействия с фосфатными группами, снижая константу диссоциации в два раза. Эти взаимодействия не зависят от последовательностей и усиливают общее сродство связывания белка.
Комбинированный эффект ZnF и IDR приводит к более прочной структуре, которая почти в 10 раз сильнее, чем только ZnF. Дополнительный анализ последовательностей других белков, содержащих IDR, показал, что этот кооперативный механизм связывания может быть более распространенным, чем считалось ранее.
«Наши результаты свидетельствуют, что IDR — не просто пассивные связующие элементы. Они активно участвуют в механизме связывания РНК и могут иметь более широкие последствия в молекулярной науке», — отмечает Китао.
Исследование предоставляет новую основу для понимания того, как белки, связывающие нуклеиновые кислоты, достигают специфичности и гибкости, что критически важно для регуляции генов. Это также открывает перспективные направления для разработки лекарств с двойным режимом распознавания.
В дальнейшем ученые планируют выяснить, действует ли этот механизм в других белках, участвующих в метаболизме РНК.
Больше информации: Soichiro Kijima et al, RNA Binding Mechanism of the FUS Zinc Finger in Concert with Its Flanking Intrinsically Disordered Region, Journal of Chemical Information and Modeling (2025). DOI: 10.1021/acs.jcim.5c01059












0 комментариев