Ученые впервые определили 3D-структуру белка ZAK, отвечающего за реакцию на клеточный стресс
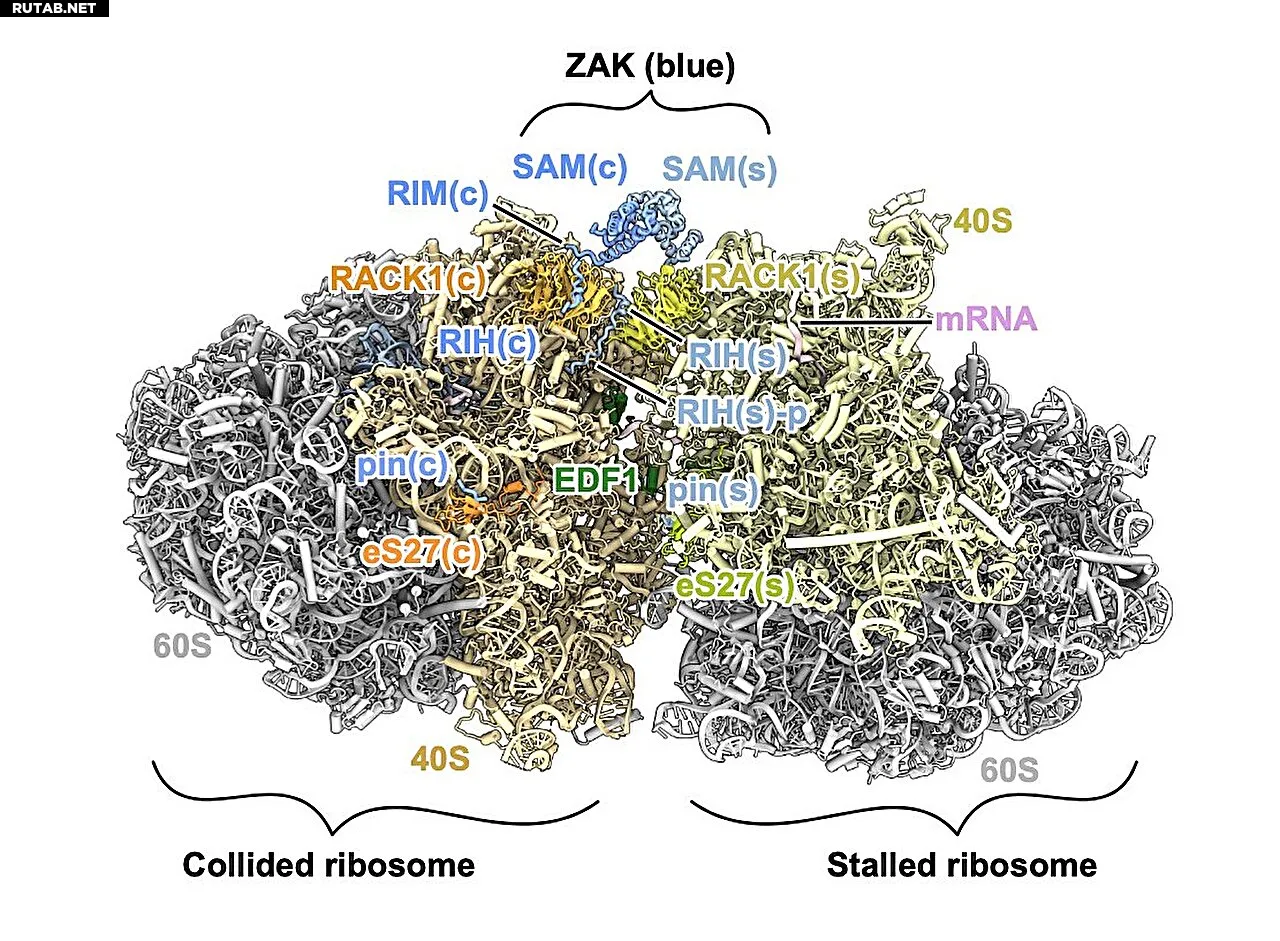
Крио-ЭМ структура белка ZAK, связанного на стыке столкнувшихся рибосом. Автор: Вена Хьюзо, Медицинская школа Джонса Хопкинса
Ученые из Университета Джонса Хопкинса и Мюнхенского университета имени Людвига и Максимилиана впервые определили трехмерную структуру белка ZAK, который играет ключевую роль в системе обнаружения повреждений клетки.
Белок ZAK давно известен своей ролью в регуляции клеточных реакций на стрессовые воздействия, такие как ультрафиолетовое облучение. Новая структура показывает молекулярные детали вплоть до атомного уровня для примерно трети белка, раскрывая механизм его активации. Это открывает путь к разработке специализированных методов лечения, нацеленных на эту сигнальную сеть.
«Чтобы разработать лекарства, нацеленные на эти белки, нам нужно понять, как они работают и как взаимодействуют с другими частями клетки», — говорит Рейчел Грин, профессор молекулярной биологии и генетики Медицинской школы Джонса Хопкинса.
Исследование, опубликованное 19 ноября в журнале Nature, стало результатом более двух лет работы. Грин специализируется на изучении динамики рибосом — макромолекулярных машин, которые перемещаются вдоль матричной РНК и декодируют ее для производства белков. При повреждении клетки УФ-светом или других стрессах рибосомы могут останавливаться, вызывая столкновения и активируя путь риботоксического стресса через белок ZAK.
«Клетка узнает о проблеме через рибосомы», — отмечает Грин, чья команда еще в 2020 году обнаружила, что столкновения рибосом активируют белок ZAK.
Для новых экспериментов исследователи использовали культивируемые человеческие клетки, в которых производились неактивные белки ZAK. С помощью препарата, вызывающего остановку рибосом, ученые индуцировали столкновения и активацию ZAK. Затем с помощью крио-электронной микроскопии (крио-ЭМ) была визуализирована структура белка.
Ученые обнаружили, что более половины белка ZAK является неструктурированной — «как спагетти», по словам Грин. Эта часть действует как щупальце, которое «цепляется» за сталкивающиеся рибосомы. Две половины ZAK образуют мост, соединяющий две столкнувшиеся рибосомы.
Исследование выявило, что С-конец белка ZAK связывается с рибосомой независимо от состояния столкновения, а область RIM в середине белка взаимодействует с белком RACK1 на рибосоме для активации ZAK при столкновениях.
Новые данные о внутреннем устройстве ZAK могут углубить понимание других киназных белков. Киназы действуют как молекулярные переключатели, добавляя химические группы к другим белкам. Большинство препаратов, нацеленных на киназы, связываются с участками, вызывающими побочные эффекты.
«Теперь мы знаем больше о строении этих специализированных сайтов в белке ZAK и можем более целенаправленно разрабатывать лекарства», — говорит Грин.
Исследовательская группа планирует продолжить изучение структуры ZAK, чтобы глубже понять механизм его активации и выяснить, чем занимается белок, когда не связан со сталкивающимися рибосомами.
Больше информации: Vienna L. Huso et al, ZAK activation at the collided ribosome, Nature (2025). DOI: 10.1038/s41586-025-09772-8





0 комментариев