Новый метод изучения мембранных белков без детергентов сохраняет их естественную структуру
Мембранные белки играют ключевую роль во многих биологических процессах и являются важными мишенями для лекарственных препаратов. Десятилетиями ученые использовали детергенты для извлечения мембранных белков из клеточных мембран для структурных исследований.
Хотя методы на основе детергентов значительно продвинули понимание структур мембранных белков, они имеют определенные ограничения, такие как трудоемкий подбор детергентов и отсутствие нативных липидов мембраны, что может препятствовать изучению липид-опосредованной регуляции.
Чтобы решить эти проблемы, исследовательская группа под руководством профессора Дан Шаньюй из Отдела наук о жизни Гонконгского университета науки и технологий (HKUST) разработала новый везикулярный метод, который сохраняет естественную липидную среду мембранных белков, что может продвинуть структурные и функциональные исследования.
Это исследование опубликовано в журнале Proceedings of the National Academy of Sciences.
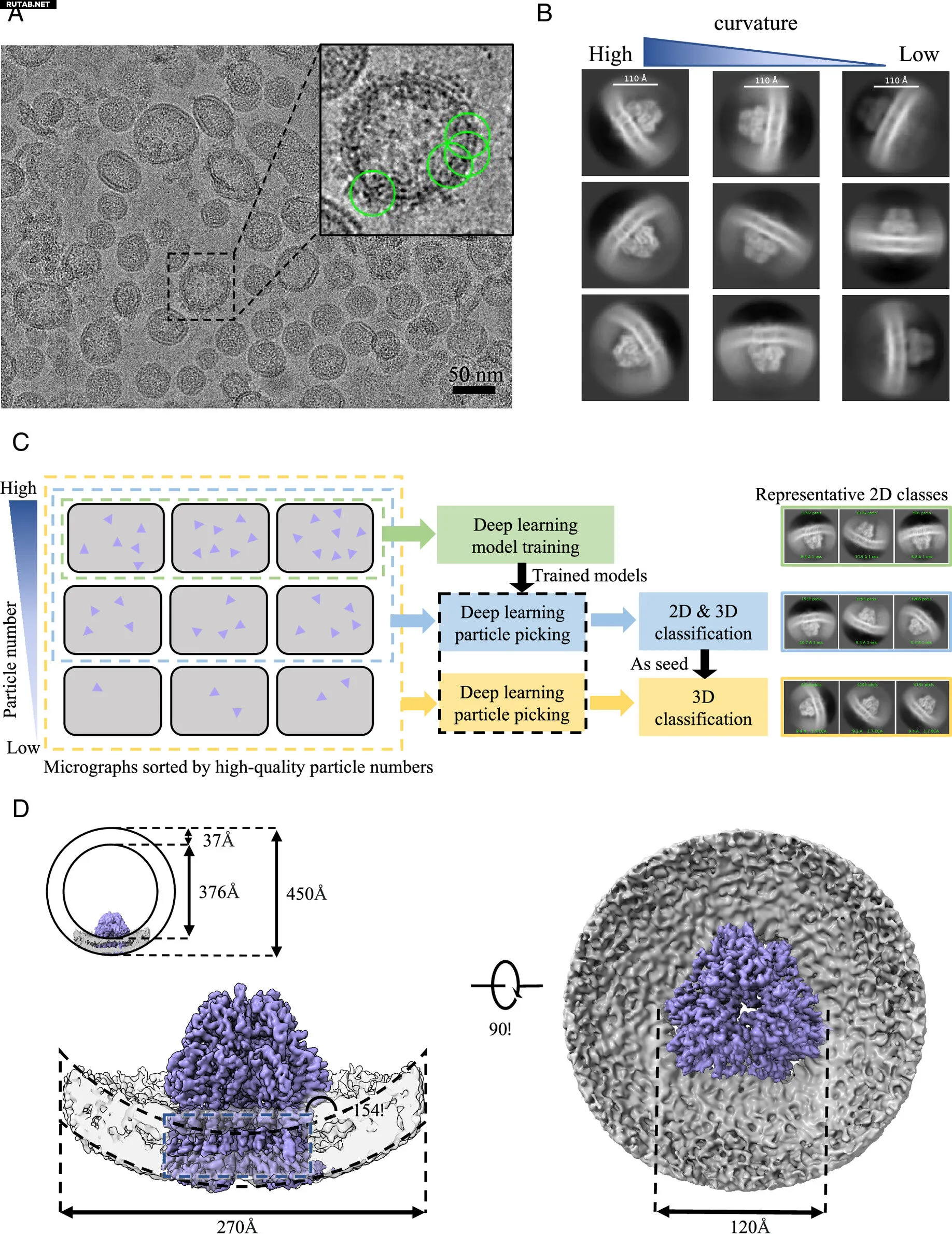
После четырех лет систематических исследований команда профессора Дан обошла необходимость очистки с помощью детергентов, напрямую генерируя везикулы, содержащие целевой белок, из клеточных мембран. Этот подход позволил получить образцы, пригодные для крио-ЭМ визуализации и структурных исследований.
Команда разработала комплексный рабочий процесс для подготовки, очистки и контроля качества везикулярных образцов, что делает этот метод применимым к различным мембранным системам.
Чтобы устранить сильный фоновый сигнал и помехи, вызванные нативной мембранной структурой, они разработали подход сортировки на основе микрографий, интегрированный с моделью искусственного интеллекта, для специфического выделения высококачественных частиц мембранных белков.
Они успешно применили этот метод к нескольким системам мембранных белков, определив структуру сверхэкспрессированного белка AcrB в мембранах клеток E. coli с разрешением 3,9 Å и структуру нативного комплекса III дыхательной цепи во внутренних мембранах митохондрий свиного сердца с разрешением 3,0 Å.
Лю Хан, кандидат наук из команды профессора Дан и первый автор исследования, сказал:
«Используя междисциплинарный подход профессора Дан, наша команда успешно разработала комплексную систему для in-situ структурных исследований мембранных белков, охватывающую как подготовку образцов, так и обработку данных, что преодолевает ранее непреодолимые проблемы».
По сравнению с традиционными методами на основе детергентов, этот новый подход предлагает ключевые преимущества, включая более низкую стоимость, более простую эксплуатацию и большую простоту использования. Что особенно важно, он сохраняет нативную мембранную среду и ключевые липидные молекулы, максимально сохраняя естественную конформацию белка.
Метод также демонстрирует универсальность, что делает его применимым к различным мембранным белкам у разных видов и клеточных мембранных структур. Он обещает значительно сократить нагрузку на исследователей, упростить определение структур мембранных белков и расширить сферу структурной биологии крио-ЭМ.
«Эта платформа на основе везикул сохраняет физиологические липидные среды, одновременно устраняя трудности подбора детергентов», — пояснил профессор Дан. — «Она предоставляет возможность изучать мембранные белки в их естественной среде. При дальнейшей оптимизации мы стремимся достичь структурной протеомики мембранных белков в специфических биологических мембранных системах, таких как митохондрии, в различных физиологических и патологических условиях, что даст ценные информацию для изучения болезней».
Больше информации: Hang Liu et al, Capturing the native structure of membrane proteins using vesicles, Proceedings of the National Academy of Sciences (2025). DOI: 10.1073/pnas.2423407122







0 комментариев