Ученые раскрыли динамику белка AP-4, важного для внутриклеточного транспорта
Адапторные белковые комплексы (AP) играют центральную роль во внутриклеточном везикулярном транспорте, связывая отбор груза с формированием везикул. AP-4, важный член семейства AP, играет ключевую роль в этом процессе. Его дисфункция нарушает транспортировку важных белков, таких как ATG9A, что приводит к их аномальному удержанию внутри клеток. Однако детали того, как AP-4 рекрутируется на мембраны и какие структурные особенности поддерживают этот процесс, оставались неясными.
В свете этого совместная команда под руководством профессоров Фэн Вэя и Чжао Яня из Института биофизики Китайской академии наук систематически выяснила конформационную динамику основного комплекса AP-4 и раскрыла молекулярные механизмы, управляющие его рекрутированием на мембраны и транспортом груза. Для этого они использовали криоэлектронную микроскопию, биохимический анализ и клеточные анализы. Их результаты опубликованы в журнале Nature Communications 21 января.
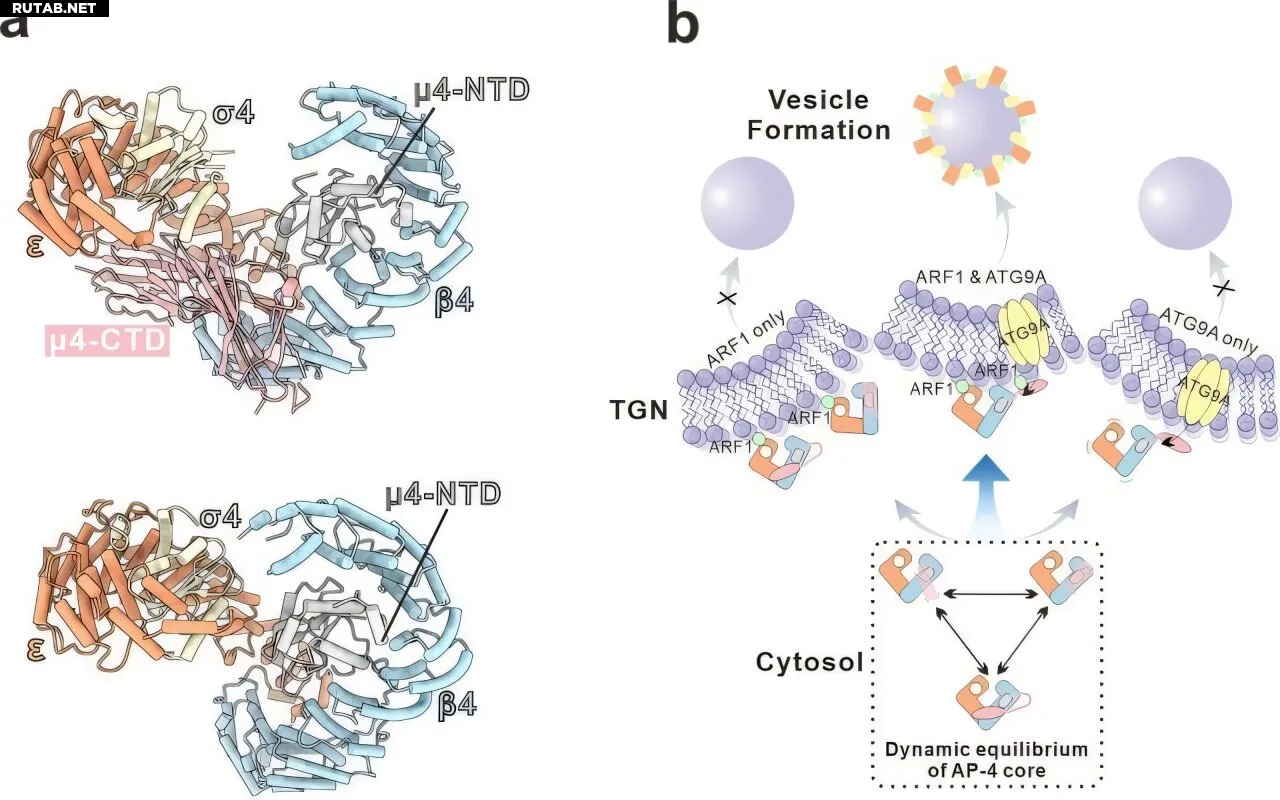
Исследователи сначала реконструировали растворимый основной комплекс AP-4 in vitro и определили его трехмерную структуру с помощью крио-ЭМ одиночных частиц. Структурные данные показали, что AP-4 не является жесткой статичной сборкой; вместо этого он существует в динамическом равновесии между «закрытыми» и «открытыми» конформационными состояниями.
Дальнейший анализ показал, что эта структурная пластичность в основном проистекает из относительно рыхлого интерфейса между средней субъединицей μ4 и основным каркасом, что обеспечивает структурную основу для переключения конформаций во время работы.
Последующая крио-ЭМ реконструкция комплекса AP-4/ARF1 продемонстрировала, что ARF1 не активирует AP-4, фиксируя его в одной конформации. Скорее, ARF1, по-видимому, модулирует рекрутирование на мембраны в рамках этого динамического конформационного ландшафта.
Измерения FRET на одиночных молекулах независимо подтвердили конформационную гибкость AP-4. Вместе с направленным на структуру мутагенезом ключевых остатков взаимодействия эти результаты подтвердили, что интерфейс AP-4-ARF1 необходим для эффективного рекрутирования на мембраны.
Исследование также показало, что нарушение внутреннего конформационного равновесия AP-4 ослабляет кооперативное действие ARF1 и ATG9A во время рекрутирования на мембраны, что приводит к аномальной внутриклеточной локализации ATG9A.
На основе интегрированных структурных, биохимических и клеточных данных исследователи предложили рабочую модель, в которой эффективное рекрутирование AP-4 на мембраны и образование везикул зависят от синергетического взаимодействия между ARF1 и белками-грузом. Потеря конформационной динамики AP-4 нарушает эту синергию и в конечном итоге препятствует везикулярному транспорту.
Переосмыслив то, как AP-4 рекрутируется на мембраны, с точки зрения конформационной регуляции, это исследование дает важные молекулярные представления о связанных с AP-4 нарушениях нейроразвития. Оно также предлагает структурную и механистическую основу для более глубокого понимания регуляции везикулярного транспорта.
Источник: Chinese Academy of Sciences







0 комментариев