Учёные раскрыли, как гликаны контролируют поведение антител
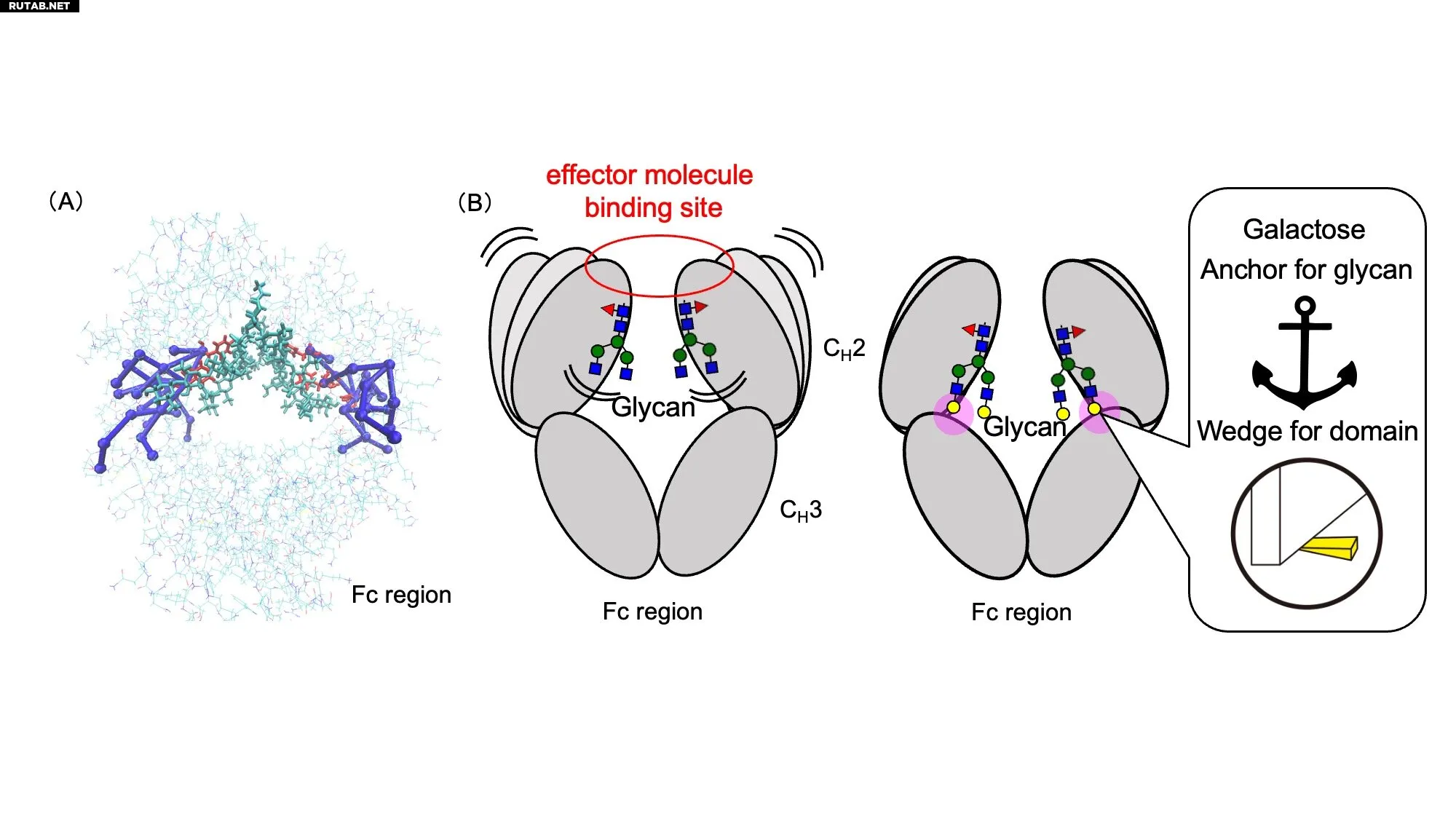
(A) Пути структурного распространения, исходящие от остатков галактозы в Fc-связанном гликане. (B) Остатки галактозы (обозначены жёлтыми кругами) подавляют подвижность гликанов, действуя как молекулярные «якоря», и ограничивают динамику Fc-домена, выступая в роли молекулярных «клиньев» — вместе это усиливает стабильность функционального сайта и способствует связыванию эффекторных молекул. Авторы: Саэко Янака, Коити Като
Международная команда учёных из Центра исследований жизни и живых систем (ExCELLS), Национальных институтов естественных наук и других учреждений раскрыла, как гликозилирование динамически модулирует архитектуру антител человека класса IgG.
Исследование, опубликованное в журнале Proceedings of the National Academy of Sciences, сосредоточено на Fc-области IgG1 и её поведении в зависимости от гликоформы.
Используя ЯМР-спектроскопию с устойчивыми изотопами и молекулярное динамическое моделирование, учёные проанализировали четыре различные гликоформы IgG1-Fc, различающиеся содержанием галактозы и фукозы. Они обнаружили, что остатки галактозы действуют как молекулярные «якоря» и «клинья», стабилизируя Fc-домен и усиливая его взаимодействие с иммунными эффекторными молекулами, такими как рецепторы Fcγ и комплемент C1q.
В отличие от этого, отсутствие основной фукозы изменяло динамику ключевых аминокислотных остатков, участвующих в антителозависимой клеточной цитотоксичности (ADCC).
Концепция «молекулярных меридианов» возникла из наблюдения, что гликан-индуцированные структурные изменения распространяются через Fc-область, соединяя удалённые домены и влияя на общее поведение антитела. Подобно меридианам в акупунктуре традиционной медицины, эти молекулярные пути передают структурные сигналы через антитело, тонко настраивая его иммунные функции.
Это исследование подчёркивает силу интеграции экспериментальных и вычислительных подходов для расшифровки динамического программирования гликопротеинов — раскрывая, как структурные сигналы от гликанов формируют поведение антител.
Эти атомарные данные о гликозилировании открывают новые возможности для гликоинженерии, позволяя разрабатывать антитела с оптимизированной клинической эффективностью для лечения рака, аутоиммунных заболеваний и инфекций. В конечном итоге эти знания могут ускорить разработку прецизионных иммунотерапий.
Дополнительная информация: Саэко Янака и др., Исследование гликоформ-зависимых динамических модуляций в человеческом иммуноглобулине G с помощью вычислительных и экспериментальных подходов, Proceedings of the National Academy of Sciences (2025). DOI: 10.1073/pnas.2505473122
Источник: National Institutes of Natural Sciences












0 комментариев