ИИ помог учёным раскрыть молекулярные механизмы действия противотуберкулёзных препаратов
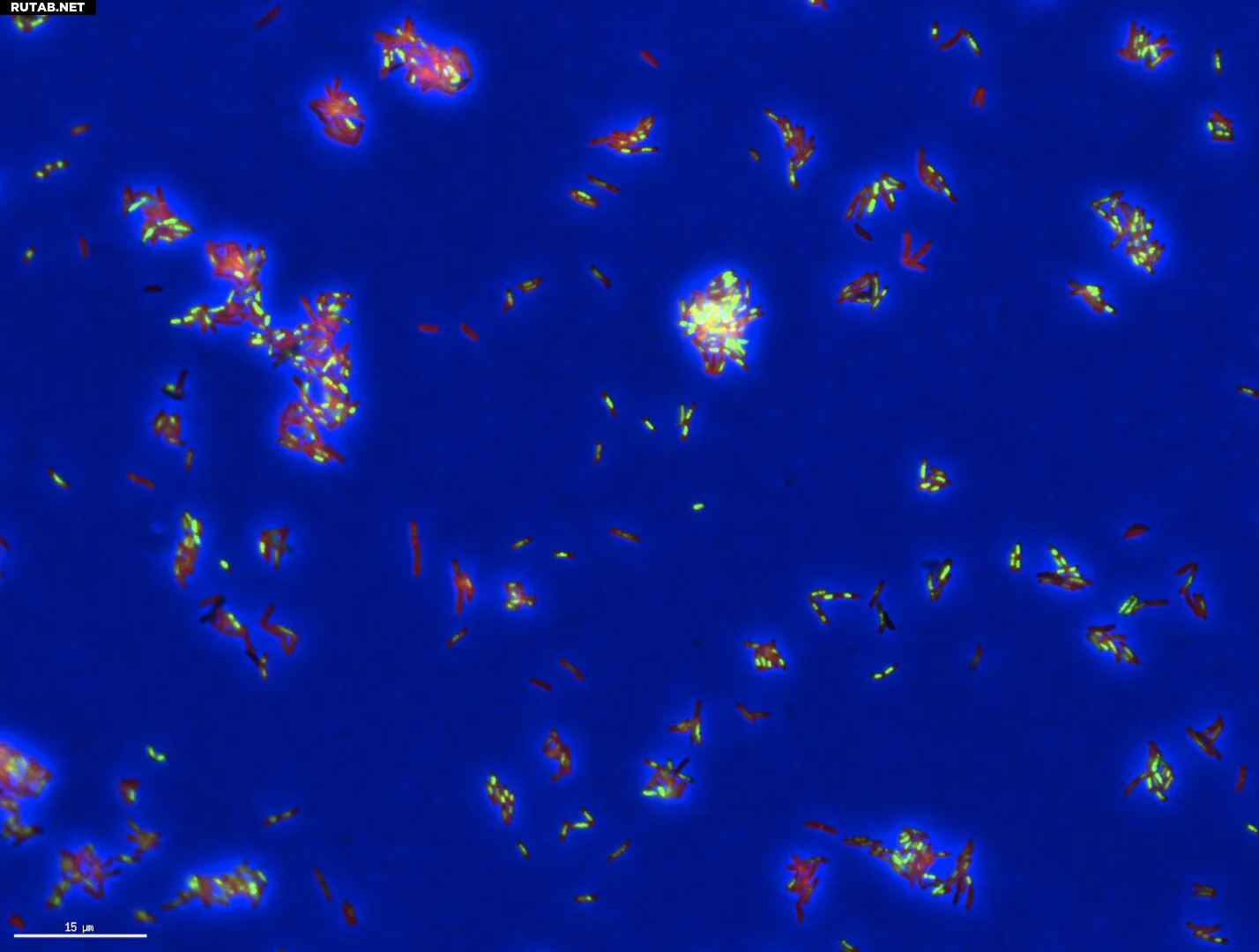
«Портрет смерти» бактерий туберкулёза, обработанных антибиотиком и окрашенных для визуализации физических особенностей отдельных клеток. Автор: Cell Systems (2025). DOI: 10.1016/j.cels.2025.101348
Туберкулёз (ТБ) остаётся самым смертоносным инфекционным заболеванием в мире и одним из самых сложных в лечении. Стандартная терапия требует приёма коктейля из нескольких препаратов в течение как минимум шести месяцев, а каждый пятый пациент сталкивается с формой туберкулёза, устойчивой к препаратам первого ряда. Новое исследование предлагает мощный метод с использованием искусственного интеллекта, который раскрывает точные механизмы уничтожения бактерий ТБ лекарствами, открывая путь к созданию более эффективных комбинаций препаратов для ускоренного лечения.
Разработка более эффективного и короткого курса лечения туберкулёза является глобальным приоритетом. «Нам нужна лучшая многокомпонентная схема: три-пять новых препаратов, которые будут работать даже против устойчивых в настоящее время форм ТБ», — говорит Бри Олдридж, старший автор исследования и профессор молекулярной биологии и микробиологии в Медицинской школе Университета Тафтса, а также профессор биомедицинской инженерии в Инженерной школе того же университета. Однако прогресс идёт медленно, отчасти потому, что учёные не имели инструментов, чтобы точно увидеть, как работают препараты и как они могут лучше всего взаимодействовать для атаки на бактерии ТБ.
«У туберкулёза, вероятно, есть несколько ахиллесовых пят, по которым мы могли бы ударить одновременно, — объясняет Олдридж, которая также является заместителем директора Центра комплексного управления антимикробной резистентностью имени Стюарта Б. Леви в Тафтсе. — Но удивительно сложно выяснить, как именно препарат убивает свою клетку-мишень».
Это похоже на вход в комнату, где вы видите синяки на лицах, опрокинутый стул и разбитую лампу; можно понять, что произошла драка, но не ясно, кто её начал и как она развивалась. Точно так же учёные могут определить, когда препарат убил клетки-мишени, но часто не знают точной цепи молекулярных событий, то есть «механизма смерти».
Олдридж и её коллабораторы из Медицинской школы Университета Тафтса и других учреждений нашли способ понять этот механизм. В новом исследовании, опубликованном в Cell Systems, они продемонстрировали, как их новый инструмент с поддержкой ИИ — DECIPHAER (decoding cross-modal information of pharmacologies via autoencoders) — может раскрывать в молекулярных деталях, как потенциальные противотуберкулёзные препараты убивают бактерии.
Инструмент основан на более ранних исследованиях команды, в которых были получены высококачественные изображения бактерий ТБ в процессе гибели под воздействием лечения. Эти снимки раскрывают подсказки — например, изменения формы бактериальных клеток или их внутренней структуры, — вызванные способом атаки препарата. Учёные используют этот «морфологический профилинг» как своего рода расследование на месте преступления для клеток: они обрабатывают бактерии ТБ новым препаратом, замораживают их в момент смерти и сравнивают полученные клеточные повреждения с паттернами, наблюдаемыми от известных антибиотиков.
«Если вы обработаете бактерии ТБ новым препаратом, и они “размажутся” так же, как и под действием других препаратов, разрушающих клеточную стенку, то можно предположить, что он тоже разрушает клеточную стенку», — говорит Олдридж.
С помощью ИИ команда пошла на шаг дальше, связав эти визуальные подсказки с детальными данными об активности бактериальных генов, известными как транскрипционные профили. Исследователи обучили модель определять, какие молекулярные изменения, такие как включение или выключение бактериальных генов, происходят одновременно с определёнными визуальными изменениями.
«Раньше мы могли лишь примерно сказать, как препарат убивает ТБ, используя морфологическое профилирование. Теперь мы можем получить более точное представление о том, как препараты воздействуют на клетки и почему бактерии умирают», — говорит Олдридж.
Например, в ходе тестирования DECIPHAER команда обнаружила, что один из противотуберкулёзных препаратов, находящийся в клинической разработке, работает не так, как ожидалось.
«Основываясь на существующих похожих соединениях, мы предположили, что препарат работает, разрушая клеточную стенку, — отмечает она. — Но на самом деле он убивает бактерии ТБ, нарушая дыхательную цепь и способность клеток производить энергию».
Поскольку инструмент ИИ может предсказать молекулярное воздействие препарата, используя только изображения — что значительно дешевле, чем применение РНК-секвенирования, — он может быстрее раскрывать, как потенциальные методы лечения ТБ работают в различных условиях роста, генетических штаммах или комбинациях препаратов.
«Мы планируем продолжать использовать его в исследованиях комбинаций препаратов в нашей собственной лаборатории и надеемся, что он поддержит коллаборации по всему миру для ускорения разработки новых препаратов против ТБ», — говорит Олдридж.
Хотя потребность особенно остра именно для туберкулёза, она добавляет, что подход DECIPHAER также может быть применён к другим инфекционным заболеваниям и раку.
Больше информации: William C. Johnson et al, Integration of multi-modal measurements identifies critical mechanisms of tuberculosis drug action, Cell Systems (2025). DOI: 10.1016/j.cels.2025.101348
Источник: Tufts University





0 комментариев