Учёные обнаружили скрытый молекулярный контур, питающий смертельный рак поджелудочной железы
Протоковая аденокарцинома поджелудочной железы (PDAC) является самым распространённым и самым смертоносным типом рака поджелудочной железы. Большинство стратегий лечения сосредоточены на блокировании часто мутирующего онкогена KRAS. Хотя этот подход может работать в некоторых случаях, многие опухоли PDAC в конечном итоге ускользают от такой терапии. Исследователи полагают, что комбинированные методы лечения, воздействующие на дополнительные молекулярные мишени, могут однажды помочь преодолеть эту устойчивость.
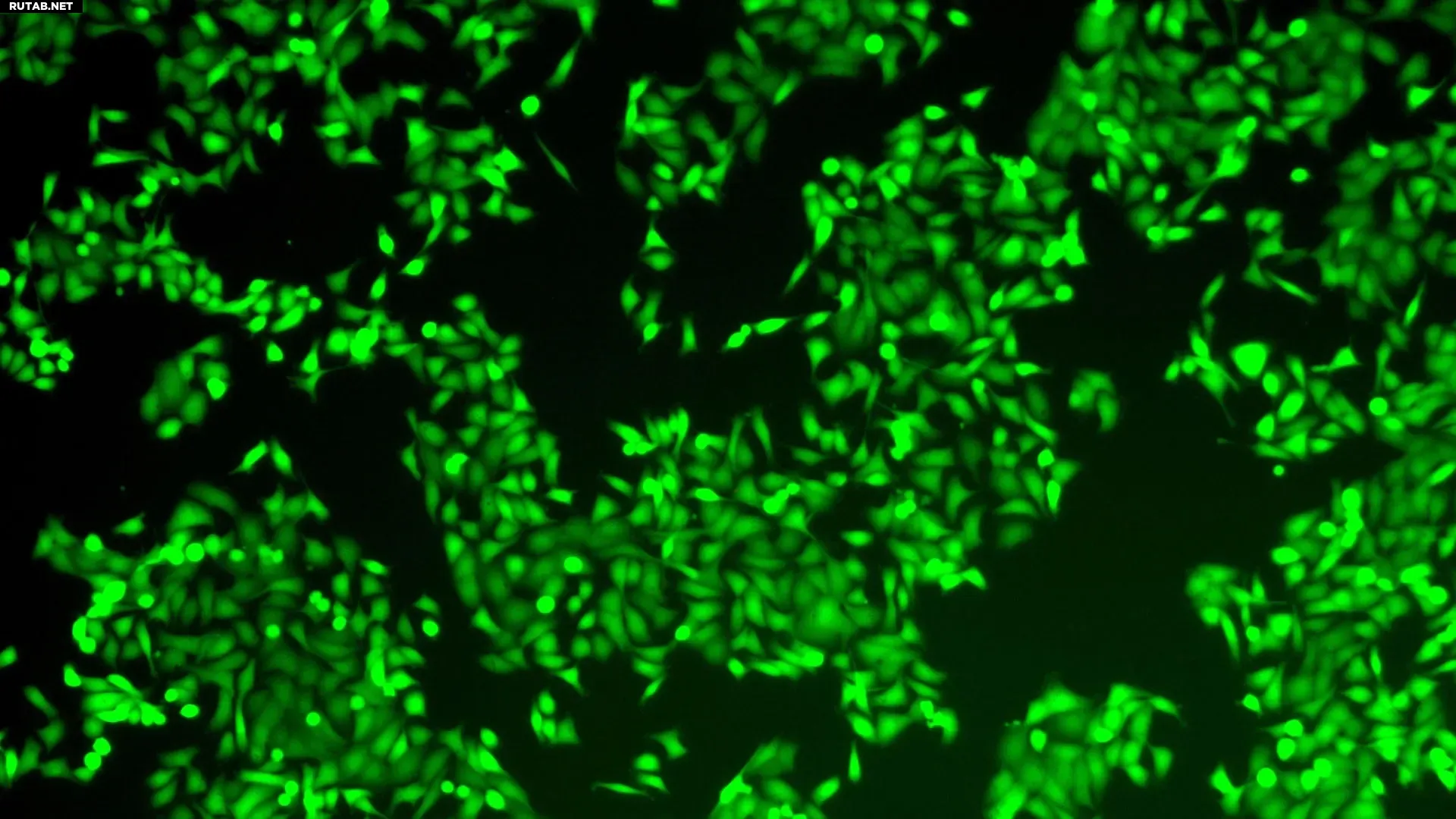
Лаборатория Крайнера в CSHL обнаружила ключевой онкогенный контур, управляющий агрессивным течением протоковой аденокарциномы поджелудочной железы (PDAC). Используя органоиды опухолей PDAC человека, команда разработала потенциальную терапию на основе сплайсинга РНК, которая разрушает этот контур. Фото: Krainer lab/CSHL
В 2023 году исследователи из лаборатории профессора Колд-Спринг-Харбор Адриана Крайнера идентифицировали белок SRSF1 как ранний триггер образования опухолей PDAC. Глубоко изучив данные того исследования, новая команда под руководством бывшего аспиранта CSHL Александра Краля обнаружила, что SRSF1 действует не в одиночку. Вместо этого он работает как часть трёхкомпонентной молекулярной системы, которая заставляет рак становиться более агрессивным.
«Наша теория заключалась в том, что некоторые изменения, вызванные повышенным уровнем SRSF1, играют роль в ускоренном росте опухоли, который мы наблюдали, — объясняет Краль. — Мы сосредоточились на молекуле, которая, как мы думали, может быть важным драйвером этого процесса, под названием киназа Aurora A (AURKA). Мы обнаружили, что она является частью сложного регуляторного контура, который включает не только AURKA и SRSF1, но и другой ключевой онкоген — MYC».
В этой системе SRSF1 контролирует AURKA, изменяя способ обработки его генетических инструкций с помощью механизма, известного как альтернативный сплайсинг. Это приводит к повышению уровня AURKA, который, в свою очередь, помогает стабилизировать и защищать белок MYC. MYC, в свою очередь, стимулирует выработку SRSF1, снова запуская весь процесс и позволяя петле, способствующей развитию рака, продолжаться.
«Фрагменты этого контура были известны ранее, но полной картины у нас не было до сих пор, — говорит Крайнер. — Как только мы выяснили, что задействован альтернативный сплайсинг AURKA, мы смогли начать поиск способов его нарушить».
Чтобы вмешаться в этот процесс, команда создала антисмысловой олигонуклеотид (ASO), предназначенный для изменения сплайсинга AURKA. ASO — это короткие синтетические молекулы, в разработке которых у лаборатории Крайнера есть большой опыт. Ранее группа создала препарат Спинразу — первое в истории лечение спинальной мышечной атрофии, одобренное FDA.
Основываясь на своих предыдущих выводах, исследователи ожидали, что новый ASO заблокирует сплайсинг AURKA. Вместо этого в клетках рака поджелудочной железы эффект оказался гораздо более драматичным. Лечение привело к полному разрушению всего ракового контура. Опухолевые клетки потеряли жизнеспособность и активировали апоптоз — форму запрограммированной клеточной смерти.
«Это как убить трёх зайцев одним выстрелом, — объясняет Крайнер. — SRSF1, AURKA и MYC — все это онкогены, способствующие прогрессированию PDAC. Просто нацелившись на сплайсинг AURKA с помощью нашего ASO, мы видим потерю этих двух других молекул».
Лаборатория Крайнера продолжает совершенствовать ASO, хотя любое потенциальное применение у пациентов остаётся делом отдалённого будущего. Крайнер подчёркивает, что крупные медицинские достижения часто начинаются с такого фундаментального исследования. Спинраза прошла аналогичный путь, прежде чем спасти тысячи жизней. При дальнейшей доработке эта работа может однажды внести вклад в создание нового эффективного метода лечения рака поджелудочной железы.
Источники: sciencedaily.com, Cold Spring Harbor Laboratory.
Alexander J. Kral, Lu Jia, GeunYoung Sim, Ledong Wan, Yuma Ishigami, Adrian R. Krainer. Splice-switching ASOs targeting the AURKA 5′ UTR collapse an SRSF1-AURKA-MYC oncogenic circuit in pancreatic cancer. Molecular Cell, 2026; 86 (1): 60 DOI: 10.1016/j.molcel.2025.12.004
ИИ: Это фундаментальное открытие, раскрывающее сложную молекулярную петлю в агрессивном раке поджелудочной железы, даёт надежду на разработку принципиально новых таргетных терапий. Подход с использованием антисмысловых олигонуклеотидов, уже доказавший свою эффективность в других областях медицины, выглядит многообещающим для борьбы с устойчивыми формами этого смертельного заболевания.









0 комментариев