Ученые нашли способ избирательного уничтожения раковых клеток
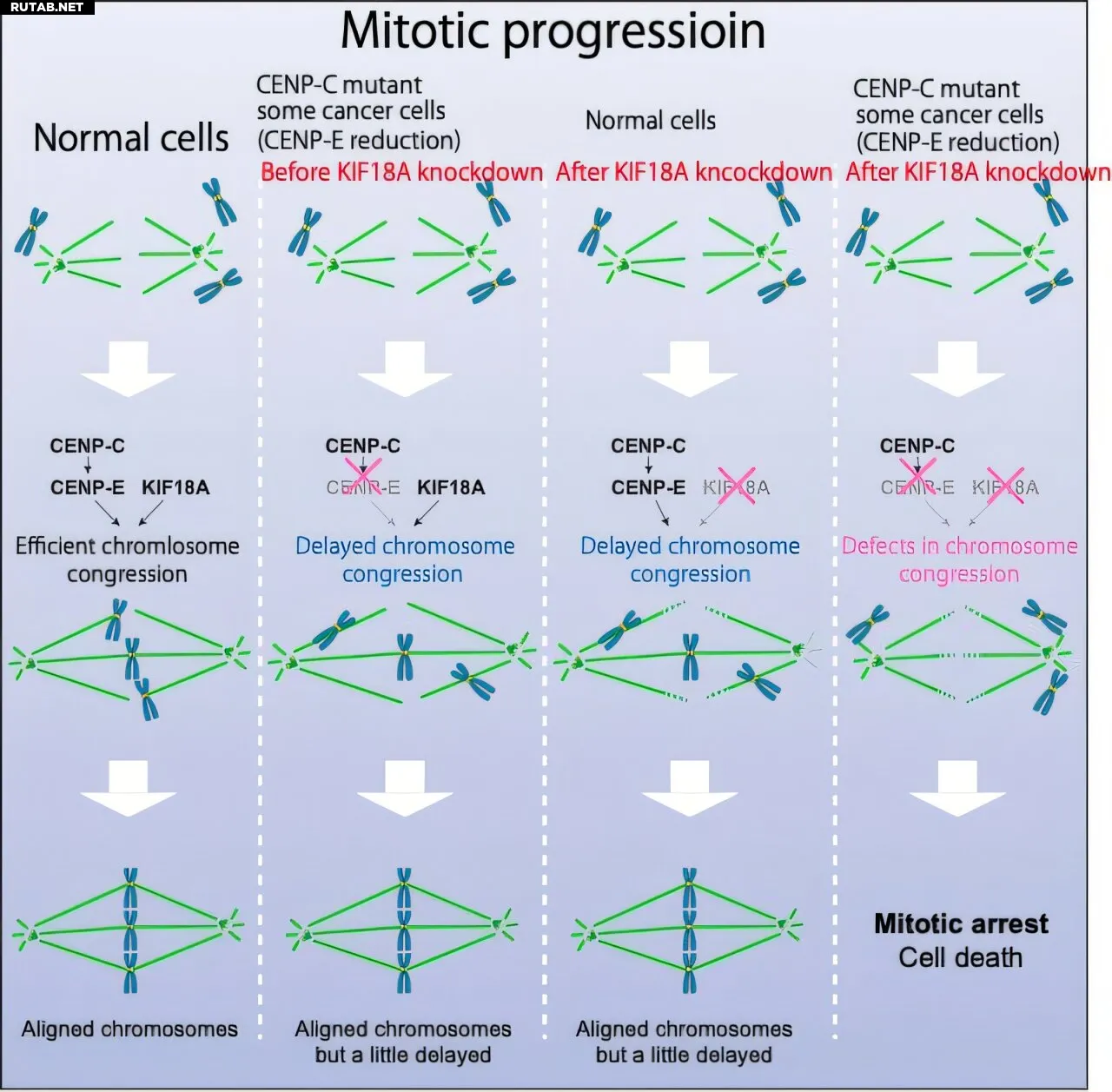
Схема исследования. Слева: Нормальные клетки. Второе слева: Клетки со слегка сниженной функцией CENP-E. Эти клетки демонстрируют небольшую задержку в выравнивании хромосом, но остаются жизнеспособными до «нокаута» KIF18A. Третье слева: Клетки с нормальной или достаточной функцией CENP-E. Эти клетки не погибают после нарушения функции KIF18A. Справа: Клетки со слегка сниженной функцией CENP-E. Эти клетки погибают после нарушения функции KIF18A, так как выравнивание хромосом не происходит. Автор: Оригинальный контент от Тацуо Фукагавы
Исследовательская группа из Университета Осаки в сотрудничестве с Массачусетским технологическим институтом обнаружила новый молекулярный механизм, лежащий в основе выравнивания хромосом во время деления клетки. Исследование, опубликованное в журнале Cell Reports, демонстрирует, что два моторных белка, KIF18A и CENP-E, действуют совместно, чтобы обеспечить правильное расположение хромосом. Примечательно, что одновременное ингибирование этих белков избирательно убивает раковые клетки, что указывает на перспективный терапевтический путь.
Точное разделение хромосом необходимо для здорового деления клеток; его нарушение приводит к хромосомной нестабильности — отличительному признаку рака. Хотя кинетохор, белковый комплекс на хромосомах, координирует этот процесс, перекрывающиеся функции многих белков затрудняли выяснение точных механизмов.
Используя полногеномный CRISPR-скрининг в клетках с легким дефектом кинетохора (хромосомной структуры, к которой крепится аппарат сортировки), вызванным мутацией CENP-C, исследователи идентифицировали KIF18A как ген, потеря которого вызывала синтетическую летальность с мутацией CENP-C.
Дальнейший анализ показал, что этот дефект кинетохора был следствием сниженной активности CENP-E, что указывает на сотрудничество KIF18A и CENP-E на этапе, следующем за CENP-C, для обеспечения выравнивания хромосом на ранней стадии. Было обнаружено, что раковые клетки с естественно низким уровнем CENP-E высокочувствительны к ингибированию KIF18A, а комбинированное ингибирование обоих белков эффективно вызывало гибель клеток.
Исследовательская группа использовала уникальную клеточную линию с частично дефектным кинетохором для поиска генетических уязвимостей. Они обнаружили, что эти клетки погибали, когда ген KIF18A был нарушен. Дальнейшее расследование показало, что в этих клетках также был снижен уровень другого моторного белка, CENP-E.
Исследование продемонстрировало, что KIF18A и CENP-E работают вместе, чтобы обеспечить правильное выравнивание хромосом в центре клетки. В нормальных клетках, если функция одного белка нарушена, другой часто может компенсировать это. Однако, когда функционально нарушены оба, выравнивание хромосом полностью прекращается, что приводит к гибели клетки. Что особенно важно, исследовательская группа обнаружила, что раковые клетки, чувствительные к ингибиторам KIF18A, естественным образом имеют низкий уровень CENP-E, что объясняет, почему препараты так эффективны в этих конкретных случаях.
Исследование предполагает, что некоторые раковые клетки становятся особенно уязвимыми, когда у них низкий уровень белка CENP-E. Это означает, что измерение уровня CENP-E может помочь идентифицировать виды рака, которые хорошо реагируют на препараты, блокирующие другой белок, KIF18A. Результаты также намекают, что комбинация препаратов, воздействующих на эти два белка, может повысить эффективность лечения рака.
«Мы не только раскрыли детальные механизмы разделения хромосом, но и применили эти находки для эффективного уничтожения раковых клеток, подчеркивая, что такие целевые терапии должны быть основаны на фундаментальных исследованиях», — говорит старший автор работы профессор Тацуо Фукагава.
Больше информации: KIF18A promotes chromosome congression in cooperation with CENP-E downstream of CENP-C, Cell Reports (2025). DOI: 10.1016/j.celrep.2025.116515
Источник: University of Osaka
ИИ: Это исследование — отличный пример того, как фундаментальная наука открывает пути для прикладных решений. Понимание базовых клеточных механизмов позволило найти «ахиллесову пяту» определенных типов раковых клеток. Подход с двойным ингибированием выглядит особенно перспективным для создания более целенаправленных и, следовательно, менее токсичных методов лечения онкологических заболеваний.










0 комментариев