Новый метод раскрывает механизмы развития амилоидоза и открывает путь к персонализированным лекарствам
Международная группа исследователей раскрыла новые молекулярные механизмы, связанные с патогенными мутациями в белке транстиретине, которые вызывают транстиретиновый амилоидоз (ATTR) — группу смертельных прогрессирующих заболеваний. Результаты, полученные благодаря новому методологическому подходу, открывают путь к разработке лекарств с более высоким терапевтическим потенциалом, созданных специально для вариантов белка, связанных с болезнью.
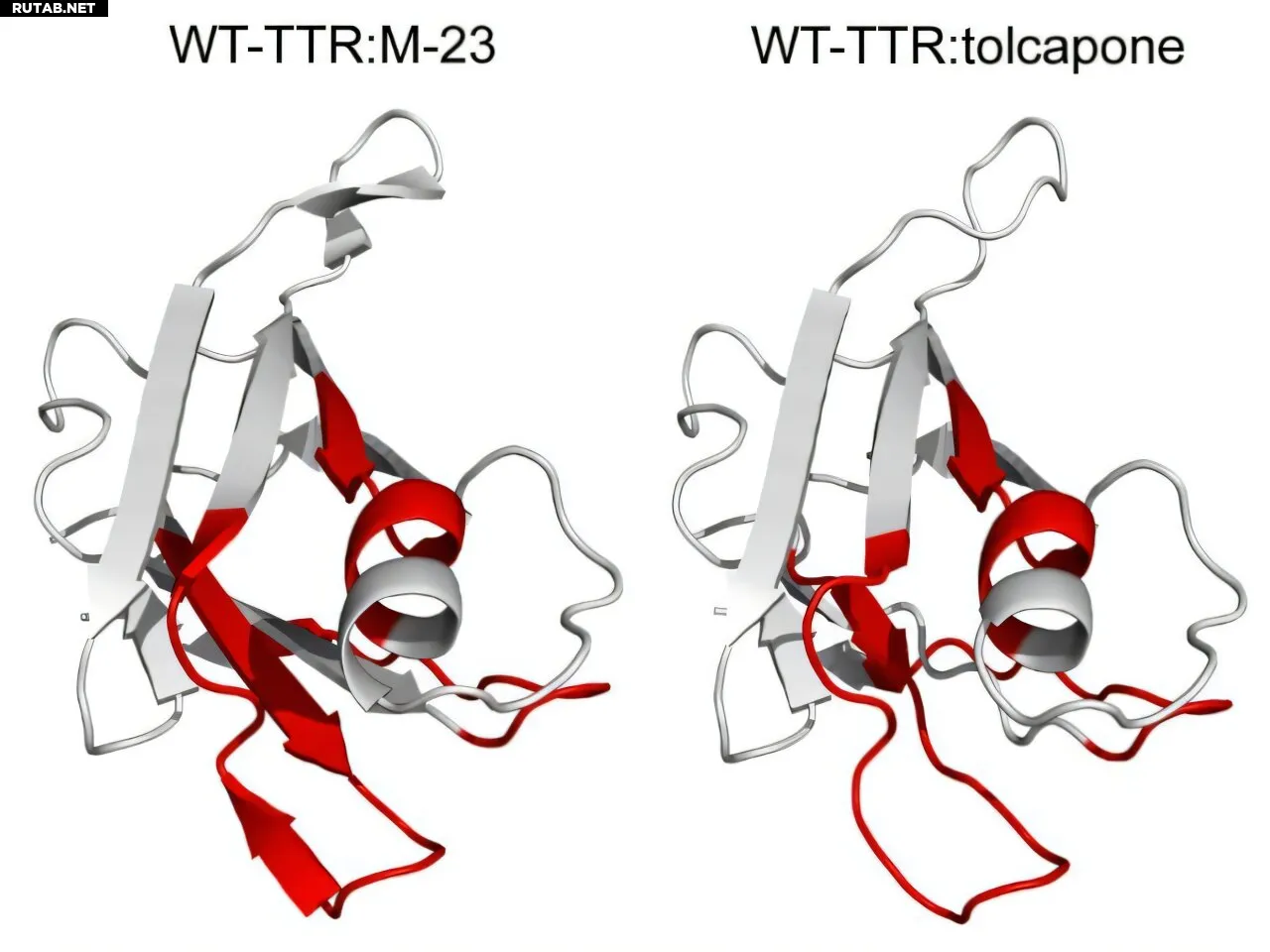
Влияние M-23 и толкапона на WT-TTR, оцененное с помощью HDX-MS. Статистически значимые изменения в HDX отображены (красным) на кристаллической структуре мономера WT-TTR. Автор: Proceedings of the National Academy of Sciences (2025). DOI: 10.1073/pnas.2519908122
Исследование было опубликовано в журнале Proceedings of the National Academy of Sciences. Работу возглавляли исследователи из Института биотехнологии и биомедицины Автономного университета Барселоны (IBB-UAB) и Университета Вашингтона в Сент-Луисе.
Понимание транстиретина и ATTR
Транстиретин (TTR) — это белок, вырабатываемый в основном в печени и, в меньшей степени, в мозге. Ряд генетических мутаций вызывает неправильное сворачивание и агрегацию TTR, который накапливается в виде амилоидных волокон в различных тканях. Это накопление приводит к набору прогрессирующих и смертельных клинических расстройств, известных как транстиретиновый амилоидоз (ATTR), которые могут поражать нервную систему, сердце и другие жизненно важные органы.
Исследования с помощью рентгеновской дифракции высокого разрешения определили более 300 структур TTR, но они дают статичное изображение белка и не улавливают эффектов, которые патогенные мутации оказывают на стабильность и конформацию TTR. Были разработаны некоторые малые молекулы (связывающие лиганды) для противодействия эффектам этих мутаций, но одобренные в настоящее время препараты обладают общей активностью и не предлагают специфического терапевтического ответа для различных фенотипических вариантов болезни. Это подчеркивает необходимость разработки новых стабилизаторов, адаптированных к каждой конкретной мутации.
Новые методы исследования и результаты
В этом исследовании ученые сосредоточились на анализе патогенных мутаций TTR, используя новый методологический подход, который позволил им сделать важные выводы относительно конформационных изменений, вызванных этими мутациями, и, в частности, того, как их стабилизирующие лиганды могут противодействовать этим эффектам. Этот метод обеспечивает динамический взгляд на механизм действия, сравнимый с «фильмом» вместо неподвижного изображения.
«Применяя масс-спектрометрию (MS) в сочетании с двумя биохимическими методами, такими как водород-дейтериевый обмен (HDX) и быстрое фотохимическое окисление белков (FPOP), мы смогли наблюдать изменения конформации, вызванные как мутациями, так и связыванием лигандов, которые невидимы для рентгеновской кристаллографии», — объясняет Иранцу Пальярес, исследователь из группы «Сворачивание белков и конформационные заболевания» в UAB.
«Мы раскрыли ранее скрытые механизмы дестабилизации, что открывает новую почву для разработки специфических стабилизаторов для каждой мутации со значительно улучшенным терапевтическим потенциалом. Таким образом, проектирование новых лигандов должно учитывать динамические характеристики каждого патогенного варианта TTR», — говорит Сальвадор Вентура, профессор кафедры биохимии и молекулярной биологии, исследователь в IBB-UAB и директор Института исследований и инноваций Парк Таули (I3PT).
Исследователи приходят к выводу, что включение методов на основе масс-спектрометрии в процесс открытия лекарств от ATTR ускорит разработку ингибиторов, способных предотвращать агрегацию вариантов, связанных с болезнью, гораздо более точным образом.
Больше информации: Франсиска Пиньейру и др., Mass spectrometry footprinting reveals how kinetic stabilizers counteract transthyretin dynamics altered by pathogenic mutations, Proceedings of the National Academy of Sciences (2025). DOI: 10.1073/pnas.2519908122
Источник: Автономный университет Барселоны
ИИ: Это исследование — отличный пример того, как переход от статического анализа к динамическому моделированию молекулярных процессов может кардинально изменить подход к разработке лекарств. Вместо «универсальных» таблеток мы движемся к эпохе настоящей персонализированной медицины, где лечение будет подбираться под конкретный генетический профиль болезни пациента. Прогресс в методах анализа, подобных HDX-MS, открывает путь к созданию лекарств следующего поколения для сложных заболеваний, связанных с неправильным сворачиванием белков.









0 комментариев