Создана первая комплексная модель кальциевого насоса клеточной мембраны
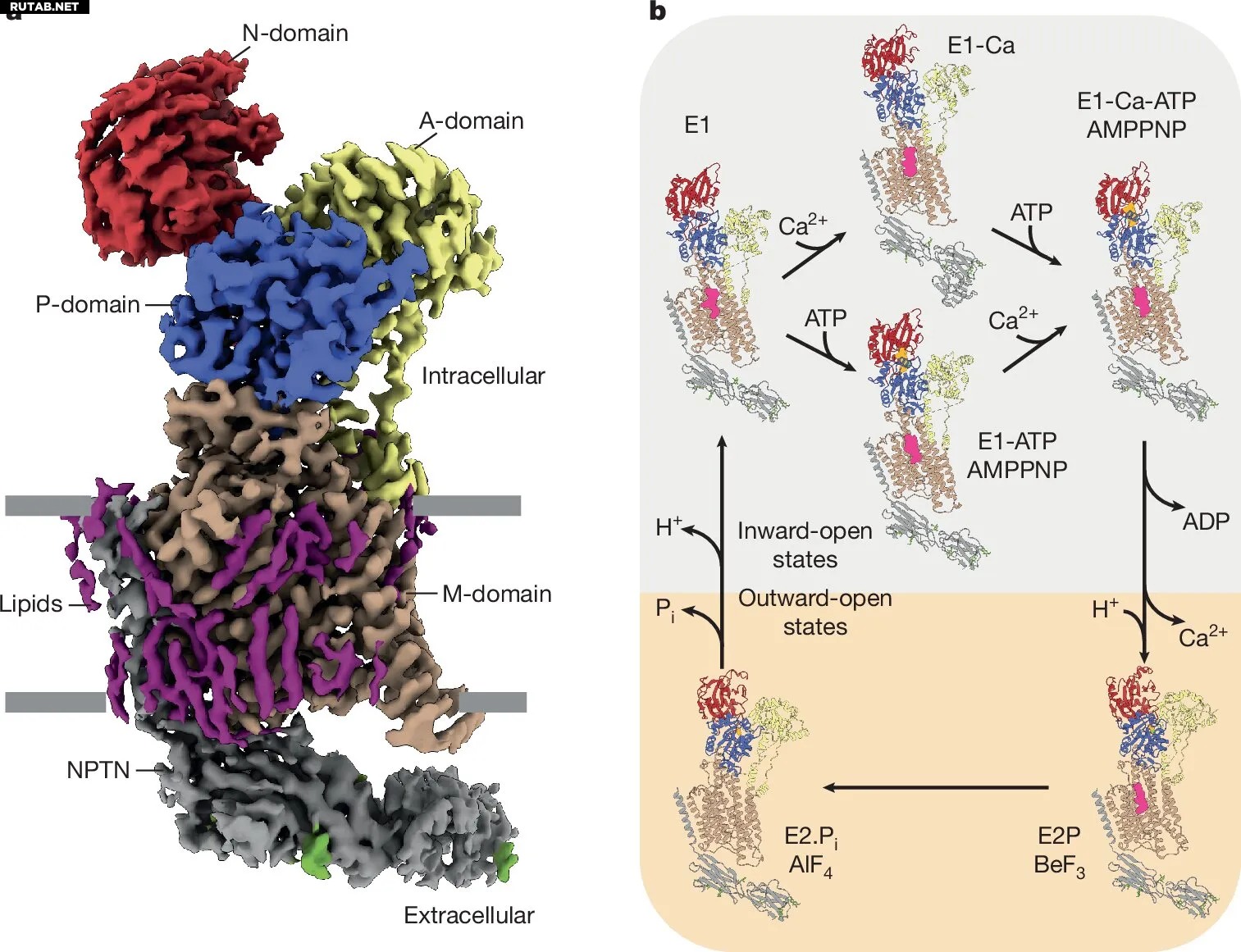
Крио-ЭМ структуры PMCA2–NPTN в различных состояниях цикла Поста–Альберса. Автор: Nature (2025). DOI: 10.1038/s41586-025-09402-3
Мы все слышали совет: «Пей молоко — будут крепкие кости и здоровые зубы». Считается, что это помогает удовлетворить высокие потребности нашего организма в кальции. Однако наши клетки поддерживают уровень кальция максимально низким. Они достигают этого, буквально выкачивая ионы кальция из своего внутреннего пространства с помощью высокоскоростных насосов в мембране.
Команде исследователей под руководством Стефана Раунзера, директора Института молекулярной физиологии Макса Планка в Дортмунде, и Бернда Факлера, директора Медицинского факультета Фрайбургского университета, удалось создать первую комплексную транспортную модель кальциевой АТФазы плазматической мембраны (PMCA), определив её 3D-структуру в различных состояниях активности и отследив PMCA-опосредованную перекачку Ca²⁺ в интактных клетках.
Исследователи смогли показать, что высокая скорость работы насоса в основном обусловлена взаимодействиями с липидом плазматической мембраны PIP2. Этот механизм может стать многообещающей отправной точкой для разработки новых препаратов, манипулирующих концентрациями кальция в клетках. Их исследование опубликовано в журнале Nature.
Концентрационный градиент как основа скорости
В нашем теле содержится примерно 1 кг кальция, большая часть которого хранится в костях и зубах. Небольшая часть кальция играет ключевую роль в контроле широкого спектра клеточных процессов, таких как мышечное сокращение, передача сигналов в нейронах, митоз, экспрессия генов и клеточная сигнализация. Уровень кальция должен точно контролироваться, поскольку дисбаланс может привести к симптомам заболеваний.
«Разница в концентрациях между внеклеточным пространством и внутриклеточной средой огромна: уровень кальция внутри клетки может быть до 50 000 раз ниже, чем снаружи клетки», — говорит Факлер.
Этот крутой концентрационный градиент фундаментален для скорости и эффективности кальций-опосредованной сигнализации в клетке. Градиент буквально выталкивает ионы кальция в клетку при открытии кальциевых каналов, и даже самые малые дополнительные количества имеют заметный эффект.
Выталкивание кальция из клетки — энергозатратный процесс
«Клеткам приходится вкладывать много энергии для поддержания этого концентрационного градиента, особенно когда речь идет об избавлении от кальция», — говорит Раунзер. — «Это как оказаться в час пик в поезде в таком городе, как Токио. Когда двери переполненного поезда открываются на пустой станции, люди буквально вырываются наружу. И наоборот, попасть в переполненный поезд требует много сил».
В Японии пассажиров в час пик в поезда заталкивает специальный персонал — «толкачи». Такие «толкачи» существуют и в клетке: кальциевые насосы активно выталкивают ионы кальция против крутого концентрационного градиента, используя клеточный источник энергии АТФ. Примечательно, что они делают это со скоростью 5000 ионов кальция в секунду. То, как поддерживается эта скорость и эффективность, до сих пор оставалось загадкой.
Удержание кальция и быстрое высвобождение
Объединив свой опыт, исследователи из Дортмунда и Фрайбурга создали первую комплексную модель того, как кальций транспортируется из клетки с помощью кальциевой АТФазы плазматической мембраны. Команда из Дортмунда использовала крио-электронную микроскопию для определения структуры насоса в различных состояниях, возникающих во время транспорта кальция, в то время как команда из Фрайбурга записывала активность насоса в живых клетках.
Исследователи выявили, что высокая скорость кальциевого насоса обеспечивается несколькими особенностями. Во-первых, кальций очень прочно связывается с насосом, облегчая инициацию. Во-вторых, кальциевый насос демонстрирует лишь незначительные структурные изменения в своих цитоплазматических доменах и минимальные области взаимодействия между этими доменами во время цикла транспорта ионов кальция, в отличие от других, более медленных насосов. Это сглаживает и ускоряет переходы между состояниями, в конечном итоге увеличивая скорость насоса.
Однако самым важным фактором является взаимодействие насоса с PIP2 — липидом, содержащимся в плазматической мембране клетки. Исследователи продемонстрировали, что PIP2 стабилизирует связывание кальция, но также способствует его быстрому высвобождению, что делает его основным фактором ускорения насоса.
Новая отправная точка для терапевтического использования
«Хотя кальций играет такую важную роль в здоровье и заболеваниях, таких как болезнь Альцгеймера, Паркинсона, сердечная недостаточность, диабет и рак, в настоящее время существует очень немного стратегий или препаратов для влияния на уровень кальция в клетках», — говорит Раунзер.
Нацеливание на кальциевый гомеостаз и сигнализацию для терапии рака стало новой областью исследований, но немного агентов продвинулись до клинических испытаний, и все они нацелены на кальциевые каналы или кальциевые насосы, отличные от PMCA.
«Интересно, что мы обнаружили, что участок связывания PIP2 представляет собой перспективную лекарственную мишень для манипулирования активностью PMCA. Это открывает новые возможности для разработки инновационных препаратов, которые могут либо увеличивать концентрацию кальция в клетках, либо индуцировать гибель клеток при таргетной терапии рака».
Больше информации: Deivanayagabarathy Vinayagam et al, Molecular mechanism of ultrafast transport by plasma membrane Ca2+-ATPases, Nature (2025). DOI: 10.1038/s41586-025-09402-3
Источник: Max Planck Society
ИИ: Это фундаментальное исследование открывает новые горизонты не только для понимания клеточных процессов, но и для разработки таргетной терапии различных заболеваний. Особенно впечатляет скорость работы этих кальциевых насосов — 5000 ионов в секунду!









0 комментариев