Учёные создали стабильные ферменты для не встречающихся в природе реакций
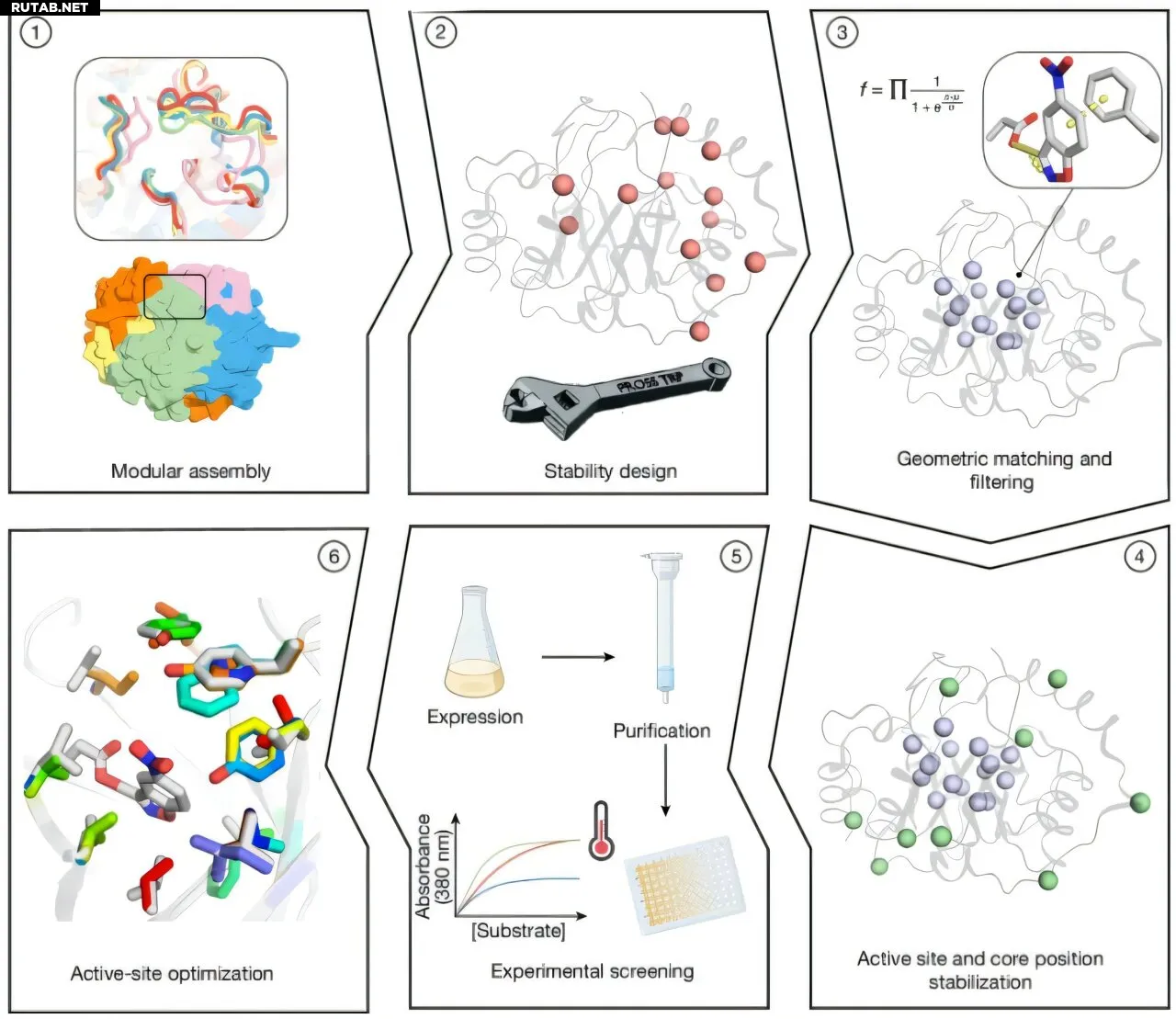
Ключевые этапы процесса разработки. Автор: Nature (2025). DOI: 10.1038/s41586-025-09136-2
Исследователи из Института науки Вейцмана представили вычислительный метод, позволяющий создавать ферменты с каталитической эффективностью, превышающей 100 000 M−1 s−1, что сопоставимо с показателями природных биокатализаторов, но без необходимости длительной оптимизации.
Природные ферменты осуществляют биохимические превращения с невероятной скоростью и точностью, задавая высокую планку, которой искусственные катализаторы до сих пор не могли достичь. Хотя вычислительные методы уже позволяли создавать белки, катализирующие реакции, не встречающиеся в природе, их скорость часто оказывалась на порядки ниже, чем у биологически эволюционировавших катализаторов.
В исследовании «Полностью вычислительный дизайн высокоэффективных ферментов для реакции Кемпа», опубликованном в журнале Nature, учёные разработали полностью компьютерный подход для создания стабильных и активных ферментов с минимальной последующей оптимизацией.
Исследователи сгенерировали тысячи структур TIM-бочонков (один из наиболее распространённых типов белковых структур у ферментов) путём комбинаторной сборки и дизайна, объединяя фрагменты гомологичных белков. В этой структуре остатки центрального β-бочонка ориентированы в сторону активного центра, что обеспечивает множество возможностей для оптимального размещения каталитических групп и групп, связывающих субстрат.
Остатки активного центра оптимизировали с помощью атомистических расчётов Rosetta, получив миллионы вариантов, которые затем фильтровали по функции, учитывающей энергию и десольватацию каталитического основания. В итоге для экспериментального тестирования отобрали 73 конструкции: 66 успешно экспрессировались в растворимой форме, а 14 продемонстрировали кооперативное поведение при термической денатурации.
Введение 5–8 мутаций в активный центр каждого варианта позволило повысить каталитическую эффективность. Один из вариантов, основанный на Des61 (дизайн 61), достиг kcat/KM 3600 M−1 s−1 (показатель каталитической эффективности) и скорости оборота 0,85 s−1 (реакций в секунду).
Восемь конструкций на основе Des27 показали каталитические скорости в 10–70 раз выше исходной, причём Des27.7 достиг kcat/KM 12 700 M−1 s−1 и kcat 2,85 s−1. Одноточечная мутация (замена Phe113 на лейцин) увеличила каталитическую эффективность до 123 000 M−1 s−1, а kcat — до 30 s−1.
Учёные пришли к выводу, что ключевым отличием этого дизайна от предыдущих примеров стало предварительное структурирование активного центра в сочетании со способностью принимать несколько каталитически компетентных конформаций, связанных с субстратом. Лучший вариант показал высокую стабильность (выше 85 °C) и каталитическую эффективность, сравнимую с природными ферментами.
Результаты подтверждают, что атомистические вычислительные методы уже достаточно надёжны для создания эффективных ферментов с естественной структурой без необходимости итеративного лабораторного скрининга или использования каркасов, сгенерированных искусственным интеллектом.
Дальнейшее развитие методов моделирования теоретических ферментов может открыть путь к полностью программируемой биокаталитической системе, способной выполнять широкий спектр задач — от производства продуктов и терапевтических применений до очистки окружающей среды, «зелёной» химии и промышленного молекулярного синтеза.
Дополнительная информация: Дина Листов и др., Полностью вычислительный дизайн высокоэффективных ферментов для реакции Кемпа, Nature (2025). DOI: 10.1038/s41586-025-09136-2
Чжофань Шэнь и др., Высокоэффективные ферменты, созданные с нуля, Nature (2025). DOI: 10.1038/d41586-025-02054-3












0 комментариев