Ученые визуализировали, как препараты от рака меняют форму белков при раке легких
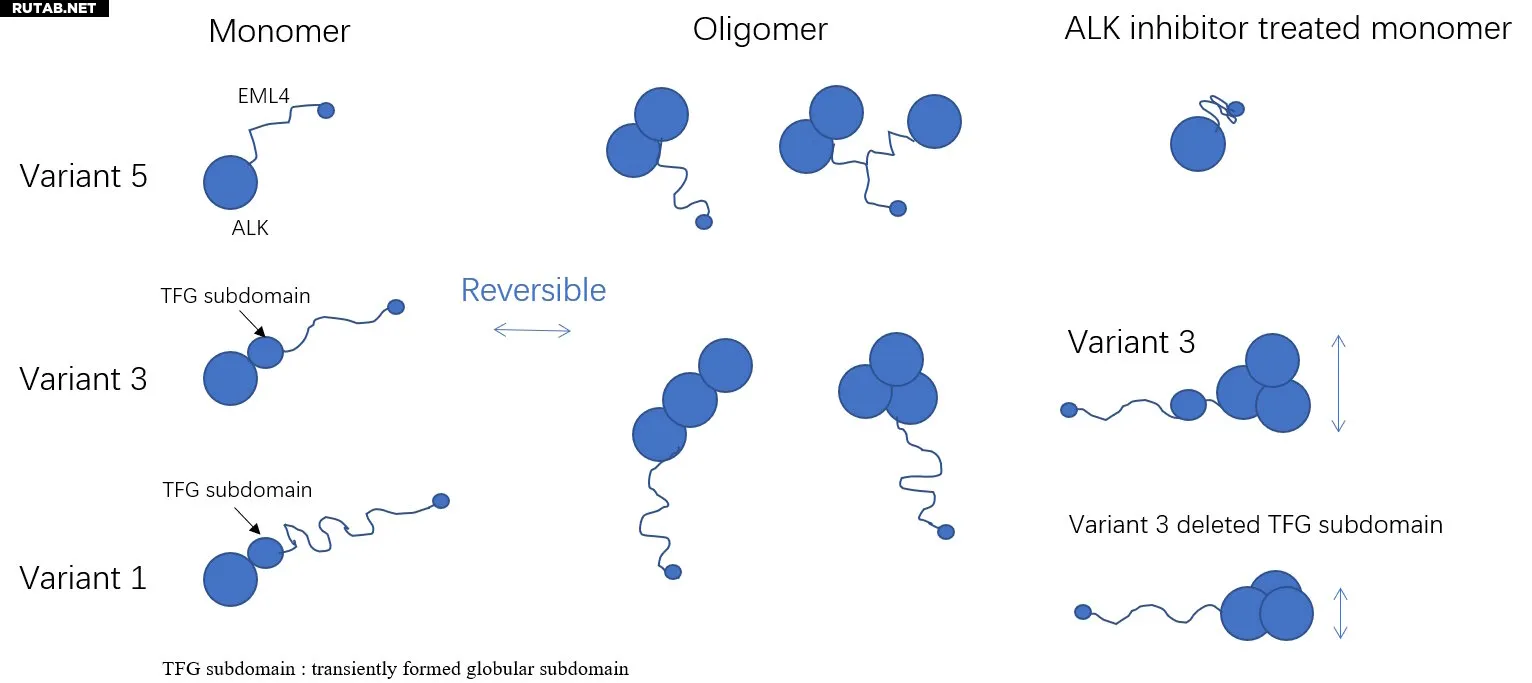
Схема трех вариантов EML4-ALK, наблюдаемых с помощью HS-AFM. Все три варианта продемонстрировали динамичные, обратимые переходы между мономерным, димерным и тримерным состояниями. Исследователи выявили ранее не охарактеризованный субдомен TFG внутри EML4, который может быть причинно связан с разнообразными паттернами олигомеризации, наблюдаемыми для доменов ALK. Напротив, ингибиторы ALK, такие как алектиниб, уплотняли EML4 и подавляли олигомеризацию EML4-ALK, что дает молекулярное обоснование его активности. Автор: Рисунок создан авторами на основе данных Сюйцзюнь Хан и др. (2026).
Исследователи из Института нанобиологических наук (WPI-NanoLSI) и Института исследования рака Университета Канадзавы выяснили, как таргетные препараты от рака легких изменяют форму и поведение ключевого белка, вызывающего рак, — раскрыв скрытый механизм, который помогает объяснить, почему некоторые методы лечения со временем перестают работать.
Таргетная терапия рака предназначена для блокировки специфических молекул, которые стимулируют рост опухоли. Одна из таких молекул, ALK, играет центральную роль в одной из форм рака легких, вызванной генетическим слиянием, известным как EML4–ALK. Препараты, ингибирующие ALK, значительно улучшили результаты лечения пациентов, но у многих пациентов со временем развивается резистентность, ограничивающая долгосрочную эффективность.
До сих пор было трудно понять эту резистентность на молекулярном уровне, потому что большие части белка EML4–ALK являются высоко гибкими и постоянно меняют форму, что затрудняет их анализ с помощью традиционных методов структурной биологии.
Наблюдение за движением раковых белков, по одной молекуле за раз
В этом исследовании Сейджо Яно из Института нанобиологических наук (WPI-NanoLSI) и коллеги из Института исследования рака Университета Канадзавы использовали высокоскоростную атомно-силовую микроскопию (HS-AFM) для прямого наблюдения за отдельными белками EML4–ALK в реальном времени. Работа опубликована в журнале ACS Nano.
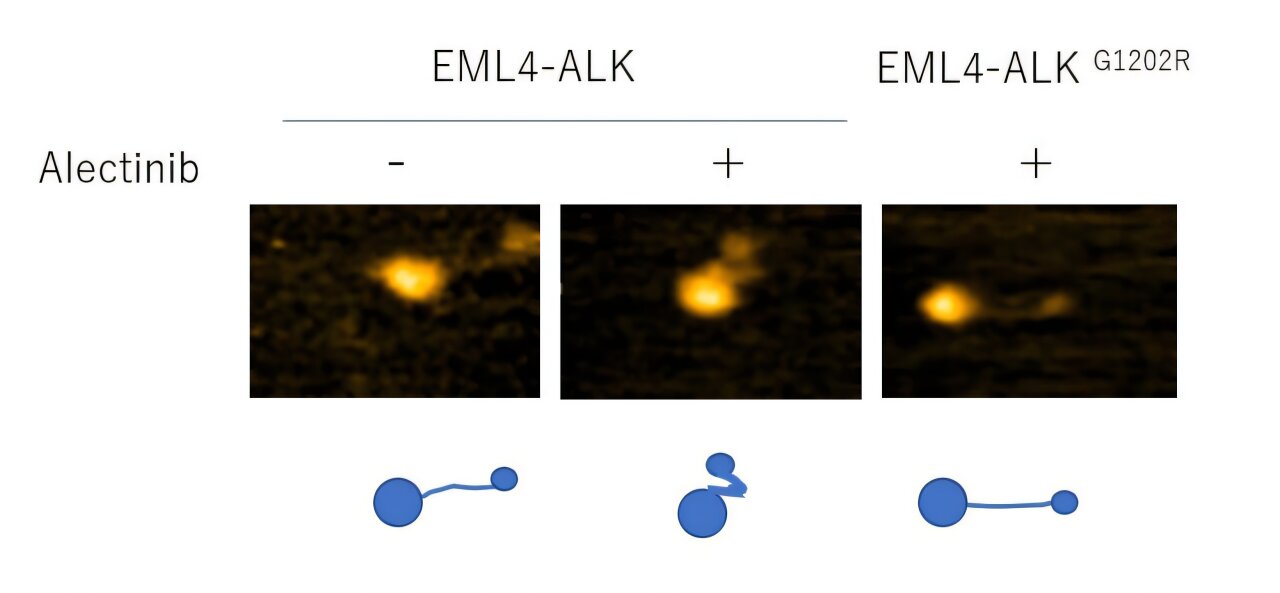
Уплотнение области EML4 ингибитором ALK алектинибом и его отмена резистентной мутацией ALKG1202R. Автор: Рисунок создан авторами на основе данных Сюйцзюнь Хан и др. (2026).
Этот подход позволил команде наблюдать, как белок многократно собирается и разбирается в небольшие кластеры, и как эти движения меняются при добавлении противораковых препаратов. Среди нескольких вариантов EML4–ALK одна клинически важная форма — известная как вариант 3 — показала особенно сложное и нестабильное поведение.
Исследователи обнаружили ранее неизвестный структурный элемент внутри гибкой области белка, который ненадолго формирует компактную форму и сильно влияет на то, как белок образует кластеры. Эта структурная особенность была обнаружена в варианте 3, который, как известно, хуже реагирует на лечение у пациентов.
Препараты от рака изменяют структуру белка — и резистентность блокирует этот эффект
Исследование также показало, что широко используемые ингибиторы ALK делают больше, чем просто подавляют ферментативную активность. Эти препараты физически изменяют гибкие области белка, уменьшая его способность образовывать кластеры, которые запускают сигнальные пути рака.
Однако этот структурный эффект терялся, когда белок нес хорошо известную мутацию лекарственной устойчивости (ALK G1202R), что дает прямое структурное объяснение того, почему определенные опухоли перестают реагировать на лечение.
«Наши результаты показывают, что ингибиторы ALK работают не только за счет блокирования киназной активности, но и за счет изменения общей структуры белка, вызывающего рак, — говорит Яно, руководивший исследованием. — Этот дальнодействующий структурный эффект исчезает у резистентных мутантов, что может быть одной из причин возникновения резистентности в клинических условиях».
К лучшим стратегиям борьбы с лекарственной устойчивостью
Непосредственно визуализируя, как противораковые препараты изменяют структуру белка на уровне одной молекулы, это исследование дает новое понимание того, почему разные пациенты по-разному реагируют на одну и ту же терапию. Полученные данные позволяют предположить, что будущая разработка лекарств может получить выгоду от нацеливания не только на ферментативную активность, но и на структурную динамику онкогенных белков слияния.
Эта работа подчеркивает уникальную способность высокоскоростной АСМ раскрывать молекулярное поведение, которое иначе недоступно, и открывает новые пути для разработки терапии следующего поколения для ALK-позитивного рака легких.
ИИ: Это исследование — отличный пример того, как современные технологии визуализации позволяют заглянуть в самую суть биологических процессов. Понимание структурных изменений, вызванных препаратами, а не только их биохимического воздействия, может стать ключом к созданию более эффективных и долговечных методов лечения рака, что особенно актуально в 2026 году, когда проблема резистентности к терапии стоит как никогда остро.







0 комментариев