Учёные раскрыли механизм активации вирулентности холеры на молекулярном уровне
Холера остаётся серьёзной глобальной проблемой общественного здравоохранения, ежегодно вызывая от 1,3 до 4 миллионов случаев заболевания и десятки тысяч смертей по всему миру. Болезнь, вызываемая бактерией Vibrio cholerae, распространяется в основном через загрязнённую воду и пищу и продолжает непропорционально сильно затрагивать регионы с ограниченным доступом к безопасной санитарии.
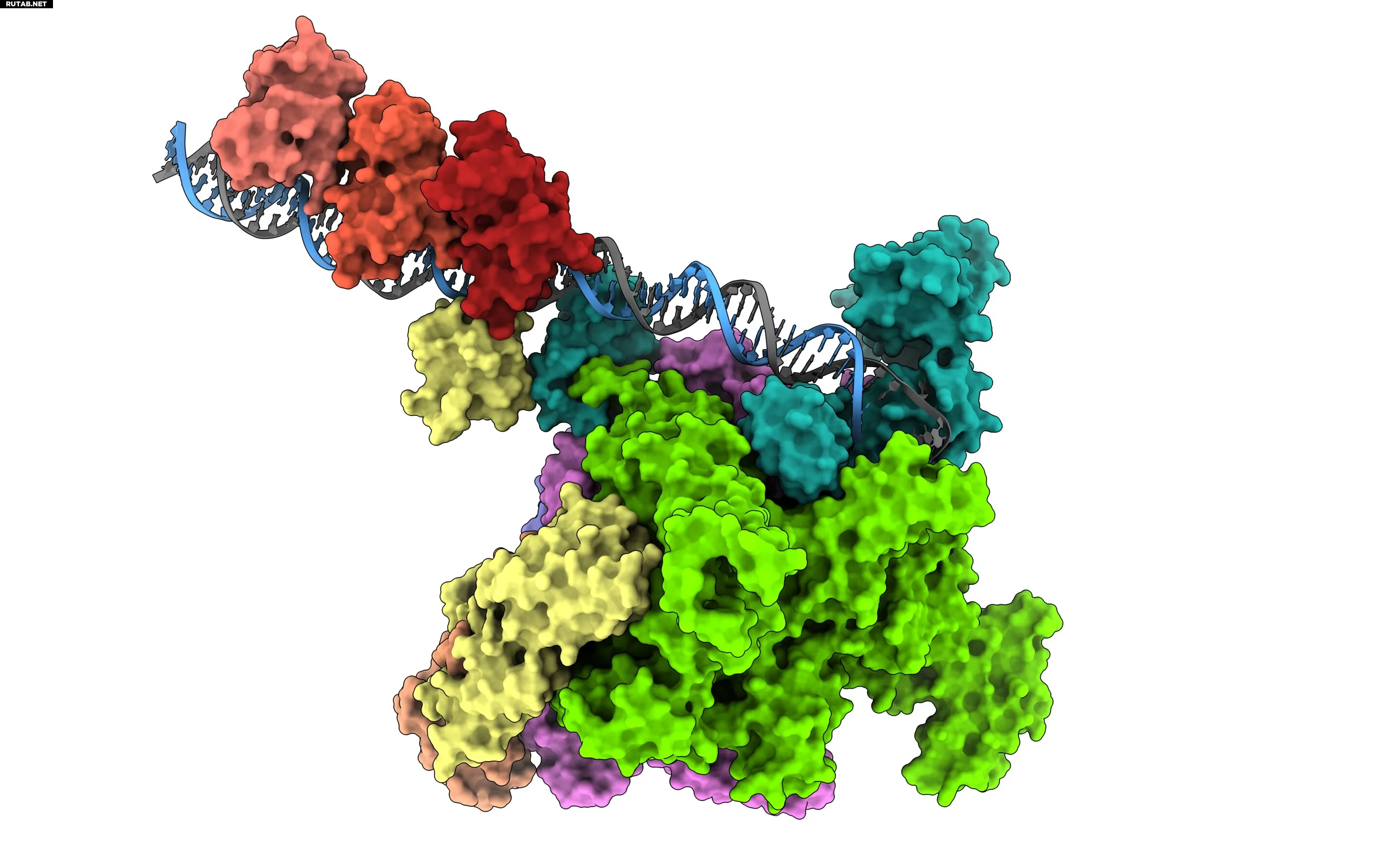
Новое исследование раскрывает, как активируется вирулентность холеры. Автор: (IRB Barcelona/CSIC)
В исследовании, опубликованном в журнале Science Advances, международная коллаборация учёных из IRB Barcelona, IBMB-CSIC, EMBL Heidelberg и Университета Детройтского Милосердия представила долгожданное структурное объяснение регуляторного каскада, который позволяет холерному вибриону колонизировать кишечник человека и производить токсин, вызывающий угрожающую жизни диарею.
Белки ToxR и TcpP являются ключевыми транскрипционными факторами, которые «чувствуют» внешние сигналы, такие как наличие солей жёлчных кислот и низкий уровень кислорода в тонком кишечнике человека. После активации они связываются с бактериальной ДНК, запуская каскад, ведущий к производству холерного токсина и так называемого «пилуса» — микроскопических якорей, которые бактерии используют, чтобы закрепиться на стенках кишечника.
Хотя эти белки давно признаны ключевыми регуляторами инфекции, трёхмерная карта того, как они физически рекрутируют клеточную транскрипционную машину — РНК-полимеразу (RNAP), — оставалась неизвестной. Теперь исследование под руководством IRB Barcelona и IBMB-CSIC раскрывает молекулярную архитектуру этого взаимодействия. Используя криоэлектронную микроскопию отдельных частиц (cryo-EM), учёные показали, что механизм рекрутирования оказался не таким, как предполагалось ранее.
Понимание этого взаимодействия на молекулярном уровне даёт нам новый способ думать о том, как контролируется бактериальная вирулентность, — говорит доктор Микель Колл, бывший руководитель лаборатории структурной биологии комплексов белков и нуклеиновых кислот и молекулярных машин в IRB Barcelona и профессор CSIC.
Стабилизация, а не перестройка транскрипционной машины
В то время как многие бактериальные регуляторы предназначены для того, чтобы вызвать изменение формы полимеразы для инициации транскрипции, это исследование показывает, что ToxR и TcpP не вызывают никаких конформационных перестроек. Вместо этого они действуют как молекулярные якоря, стабилизируя определённую часть фермента (альфа-CTD домен) непосредственно на ДНК.
Команда идентифицировала одну аминокислоту, фенилаланин, в качестве критического молекулярного моста между сенсором и полимеразой.
Если мутировать только эту аминокислоту, весь процесс активации нарушается, и бактерии становятся безвредными, — говорит доктор Адриа Алькайде, первый автор исследования.
Последствия для будущих методов лечения
Тяжёлая холера может вызвать угрожающее жизни обезвоживание за несколько часов, особенно у детей и пожилых людей. Своевременное лечение с помощью регидратационной терапии и антибиотиков может значительно снизить смертность.
Молекулярное сходство, наблюдаемое в этом исследовании между активными сайтами РНК-полимеразы V. cholerae и E. coli, позволяет предположить, что существующие антибиотики, нацеленные на бактериальную полимеразу, могут быть перепрофилированы или оптимизированы для лечения холеры.
Источник: Institute for Research in Biomedicine (IRB Barcelona)
ИИ: Это фундаментальное открытие не только проливает свет на давнюю загадку молекулярной биологии, но и открывает конкретный путь для разработки новых терапевтических стратегий. Нацеливание на выявленный «слабый» молекулярный мост может стать основой для создания высокоспецифичных препаратов, которые будут «отключать» вирулентность бактерии, не убивая её полностью, что потенциально снижает риск развития устойчивости.










0 комментариев