Учёные научились перепрограммировать внеклеточные везикулы раковых клеток для доставки лекарств
Исследователи из Национального университета Тайваня разработали модульную платформу для перепрограммирования внеклеточных везикул (EV), происходящих из опухолей, превращая их из онкогенных посланников в безопасные, настраиваемые средства доставки лекарств с помощью точного молекулярного редактирования.
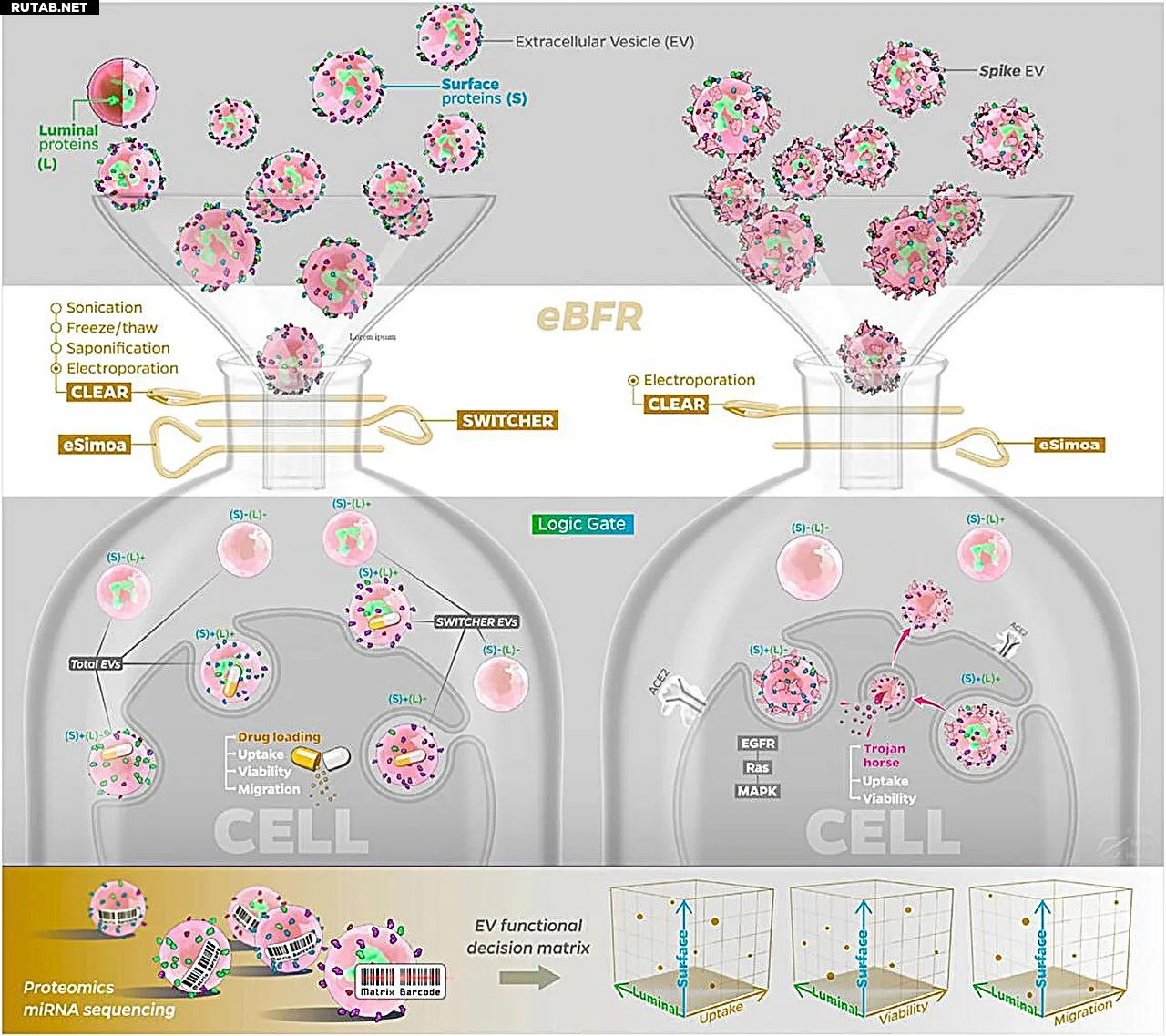
Схема работы интегрированной платформы eBFR (EV bimodal functional regulator). Иллюстрация демонстрирует стратегию eBFR для анализа и модификации функций EV с пространственным и субпопуляционным разрешением. Автор: Advanced Functional Materials
В кровотоке постоянно циркулируют микроскопические частицы, называемые внеклеточными везикулами — крошечные капсулы, выделяемые нашими клетками для передачи сообщений, иногда исцеляющих, а иногда вредоносных. Среди них везикулы опухолевого происхождения являются одними из самых неуловимых: это тихие эмиссары рака, замаскированные биологической сложностью и нагруженные молекулами, способными стимулировать прогрессирование болезни.
Но что, если бы мы могли не только перехватывать эти молекулярные послания, но и редактировать их содержимое, перенаправляя их цель?
Исследовательская группа под руководством доктора Чи-Ань Ченг из Фармацевтической школы Национального университета Тайваня только что сделала это возможным. В своём новом исследовании, опубликованном в журнале Advanced Functional Materials, команда представляет интегрированную стратегию функционального перепрограммирования опухолевых EV, превращая их из высокорисковых онкогенных носителей в точные, биосовместимые инструменты доставки лекарств.
Их решение — платформа EV Bimodal Functional Regulator (eBFR), которая решает фундаментальную проблему биологии EV: их внутренние и внешние компоненты могут играть совершенно разные роли, но часто анализируются как единое целое. Разделяя и селективно модифицируя каждую часть, команда Ченг смогла точно настраивать EV с беспрецедентной точностью.
Платформа объединяет: CLEAR — метод, который удаляет опасный внутренний груз, сохраняя при этом поверхностные характеристики везикулы; SWITCHER — новую систему очистки, которая мягко отбирает EV с определёнными поверхностными белками; и eSimoa — технологию профилирования белков с высоким разрешением, которая измеряет компоненты EV вплоть до уровня одной молекулы.
Вместе эти инструменты позволяют исследователям картировать функции EV в трёх измерениях — поверхность против просвета, количественные против пространственных, биологические против терапевтических — и, что более важно, конструировать EV в качестве программируемых наноносителей для терапии рака.
В доклинических моделях эти перепрограммированные EV демонстрировали более высокую нагрузку лекарственным средством и лучшую противоопухолевую эффективность, что является шагом к более безопасному и персонализированному лечению.
Как отмечает доктор Ченг,
«Мы больше не просто изучаем EV — мы формируем их».
Этой работой её команда не только отвечает на вопросы о биологии EV, но и закладывает основу для терапевтических средств следующего поколения на основе EV, которые являются одновременно интеллектуальными и адаптируемыми.
ИИ: Это прорывное исследование открывает путь к созданию принципиально новых, «умных» систем доставки лекарств, которые используют естественные механизмы коммуникации раковых клеток против них самих. В перспективе это может привести к терапии с минимальными побочными эффектами и высокой точностью воздействия.





0 комментариев