Как модуляция белка ACE2 может остановить проникновение коронавируса
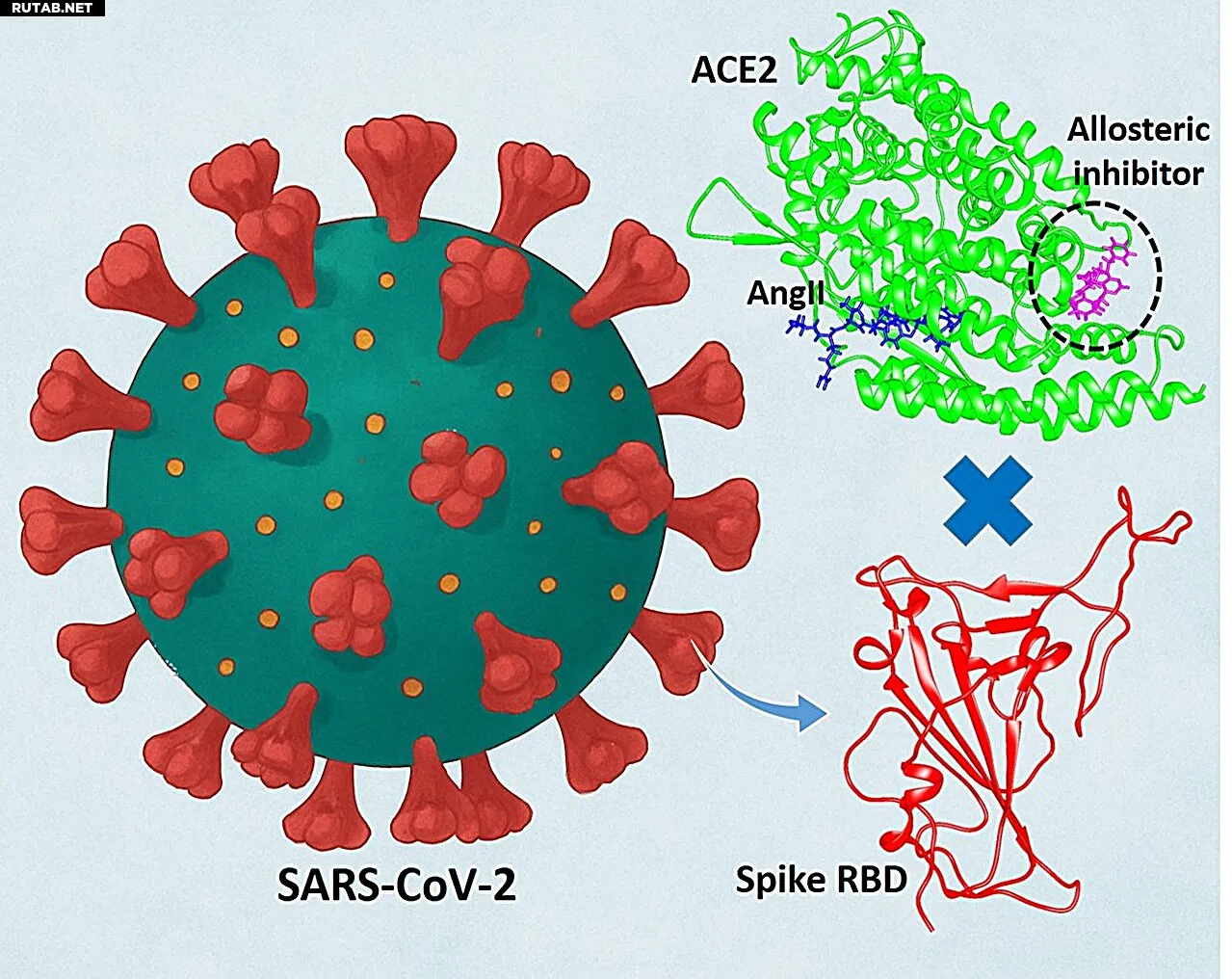
Иллюстрация показывает аллостерический ингибитор, связанный с ACE2, который блокирует взаимодействие между шиповидным белком SARS-CoV-2 и ACE2. Одновременно ингибитор усиливает связывание ACE2 с его естественным субстратом — ангиотензином II, сохраняя физиологическую функцию белка. Автор: Сародж Кумар Панда
В начале пандемии большинство исследований, включая наши, было сосредоточено на разработке препаратов, блокирующих шиповидный белок вируса. Это был логичный первый шаг, но, как мы увидели, вирус оказался «движущейся мишенью». Он быстро мутировал, и новые варианты приобретали устойчивость из-за изменений в поверхностном гликопротеине (S-белке).
Это подчеркнуло серьёзную проблему: останутся ли наши методы лечения эффективными по мере эволюции вируса? Вместо того чтобы постоянно «догонять» новые варианты, мы задались вопросом: что, если сосредоточиться на реакции человеческого организма на вирус, а не только на самом вирусе?
Эта простая, но мощная идея стала основой нашего исследования, которое мы недавно опубликовали в журнале Physical Chemistry Chemical Physics.
Смена фокуса: воздействие на хозяина, а не на вирус
Вместо того чтобы атаковать вирус напрямую, мы решили изучить новую идею: воздействовать на человеческий белок, который опосредует проникновение вируса в клетки. Это привело нас к ангиотензинпревращающему ферменту 2 (ACE2) — критическому «входному» белку, который вирус использует для вторжения. ACE2 присутствует на поверхности многих клеток человека, особенно в лёгких, и играет ключевую роль в регуляции кровяного давления и здоровья сердца. К сожалению, SARS-CoV-2 захватывает этот белок как точку входа.
Это создаёт серьёзную проблему: полностью блокировать ACE2 нельзя, так как он жизненно важен для организма. Поэтому наша цель заключалась в том, чтобы затруднить вирусу использование ACE2, не нарушая его естественных функций.
Обнаружение «скрытого переключателя»
Для этого мы использовали комбинацию методов вычислительной химии. Наше исследование отошло от традиционных подходов: вместо блокировки вирус-связывающего домена ACE2 мы применили аллостерический анализ, чтобы обнаружить «скрытый» аллостерический сайт белка. Этот сайт действует как молекулярный переключатель, который при активации может изменять поведение всего белка.
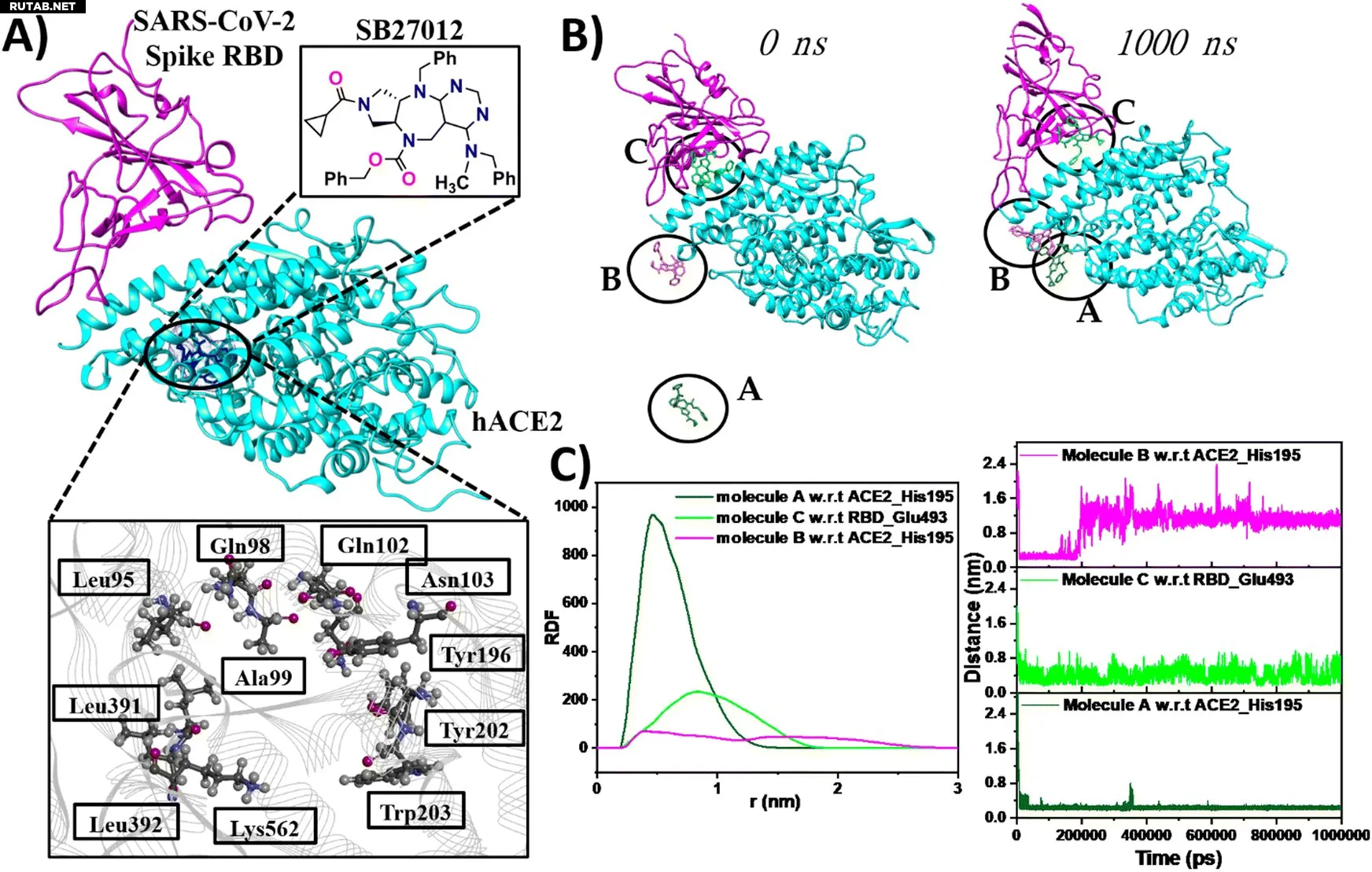
С помощью молекулярно-динамического моделирования (MD) мы визуализировали взаимодействие ACE2 и вируса на атомном уровне. Наши симуляции показали, что малая молекула-модулятор может связываться с этим аллостерическим карманом, расположенным вдали от основного сайта взаимодействия с вирусом. Расчёты свободной энергии связывания подтвердили, что наши соединения эффективно взаимодействуют с этим участком.
(A) Поза связывания SB27012 в комплексе hACE2–шиповидный белок, (B) динамика связывания трёх молекул SB27012 за 1000 нс, (C) анализ радиального распределения и расстояний. Автор: Physical Chemistry Chemical Physics (2025). DOI: 10.1039/D5CP01740H
Двойное преимущество: блокировка вируса и поддержка организма
Когда подходящая малая молекула связывается с аллостерическим карманом ACE2, это вызывает конформационные изменения, ослабляющие связь с шиповидным белком вируса. При этом естественная функция ACE2 не только сохраняется, но и усиливается — его каталитическая активность в отношении ангиотензина II (ключевого регулятора давления) возрастает.
Этот механизм можно сравнить с настройкой замка: родной ключ (ангиотензин II) подходит ещё лучше, а поддельный (вирус) больше не работает.
Перспективы: более устойчивая защита
Такой подход имеет важное преимущество: вирусы быстро мутируют, но белки человека остаются стабильными. Воздействуя на них, мы создаём более долговечную защиту от новых вариантов SARS-CoV-2.
Исследование проводилось в Индийском институте науки, образования и исследований (IISER) в Берхампуре. Над проектом работали Пратьюш Пани (аспирант) и руководитель группы доктор Малай Кумар Рана, объединив методы вычислительной биологии и биофизики.
Дополнительная информация: Pratyush Pani et al, Modulating functional allostery of the host-cell receptor protein hACE2 to inhibit viral entry of SARS-CoV-2, Physical Chemistry Chemical Physics (2025). DOI: 10.1039/D5CP01740H






0 комментариев