Учёные раскрыли механизм устойчивости супергрибка Candida auris к противогрибковым препаратам
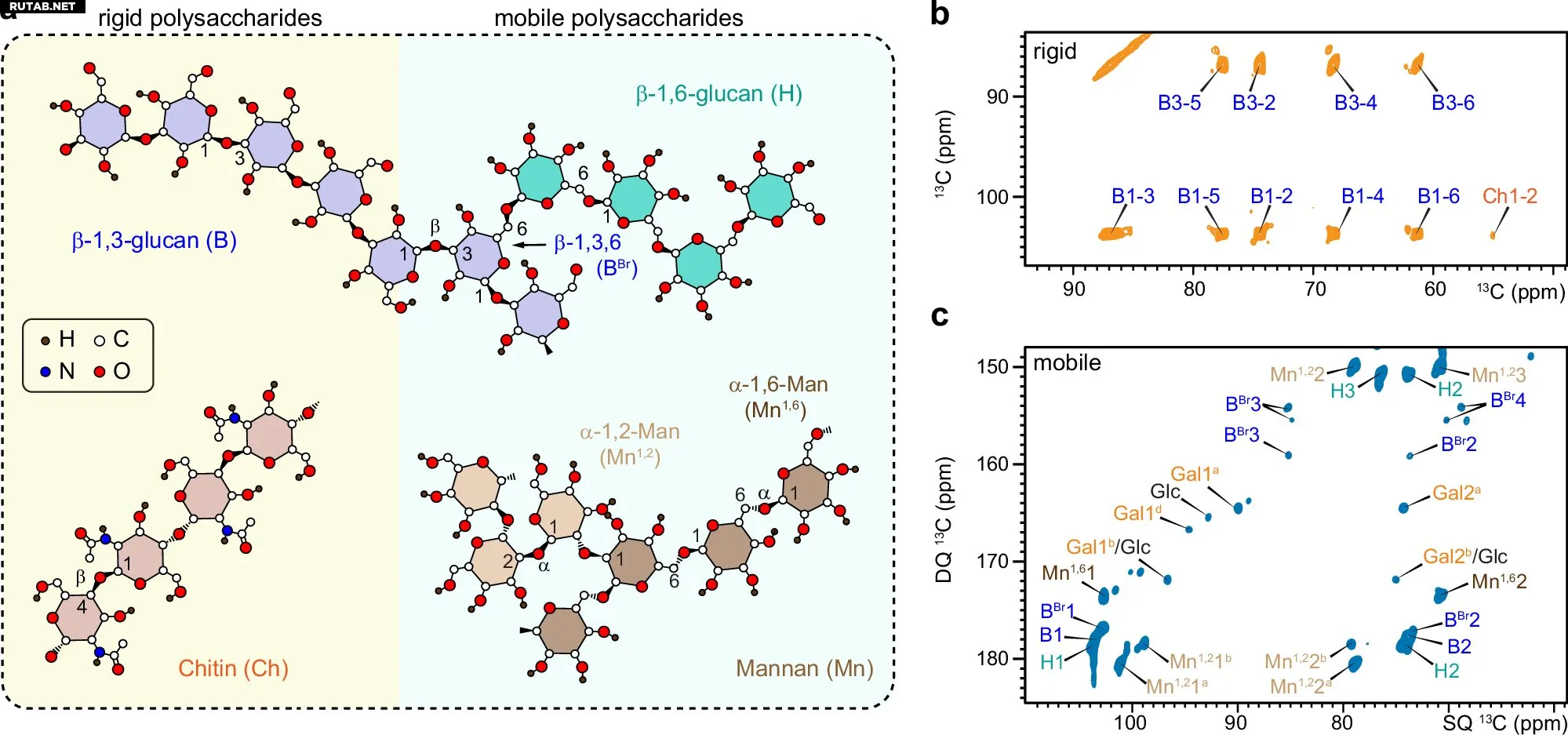
Динамически различные углеводные домены у видов Candida. Автор: Nature Communications (2025). DOI: 10.1038/s41467-025-61678-1
Новаторское исследование Мичиганского государственного университета (MSU), опубликованное в журнале Nature Communications, раскрывает, как устойчивый к множеству препаратов супергрибок Candida auris реконструирует свою клеточную стенку, чтобы выжить при противогрибковой терапии. Это открытие — важный шаг в понимании и борьбе с одним из самых опасных грибковых патогенов, угрожающих госпитализированным пациентам по всему миру.
Исследование, проведённое под руководством Туо Вана, профессора кафедры химии имени Карла Брубейкера, сравнивает C. auris с его более распространённым родственником — Candida albicans. Хотя оба вида имеют схожую структуру клеточной стенки, исследование показывает, что они используют принципиально разные стратегии для сопротивления эхинокандинам — классу основных противогрибковых препаратов.
«Инвазивные инфекции, вызываемые видами Candida, представляют растущую угрозу, особенно с появлением устойчивых к лекарствам видов, таких как C. auris, и осложнений, связанных с кандидозом на фоне COVID-19», — пояснил Ван. «Наше исследование даёт детальное представление о том, как эти грибы адаптируются к лечению».
С помощью передовой спектроскопии ядерного магнитного резонанса в твёрдом теле команда обнаружила, что у обоих грибов наблюдается упрочнение ключевых полисахаридов клеточной стенки — таких как β-1,6-глюканы и маннановые боковые цепи — при обработке противогрибковым препаратом каспофунгином.
Однако если C. albicans реагирует утолщением клеточной стенки и изменением динамики хитина и глюканов, то C. auris использует другой подход: он увеличивает выработку β-1,6-глюкана для сохранения структурной целостности.
Исследование также проливает свет на давнюю загадку роли β-1,6-глюкана — малоизученного компонента грибковых клеточных стенок, который, как оказалось, играет ключевую роль в устойчивости к лекарствам.
«Удаление гена и последующий структурный анализ показали, что β-1,6-глюкан напрямую связан с тем, как C. auris реагирует на противогрибковые препараты, такие как микафунгин и каспофунгин», — объяснил Ван.
В междисциплинарную исследовательскую группу вошли аспиранты MSU Калпана Сингх и Малита Диквелла Виданаге, приглашённый учёный Ифань Сюй (вскоре поступающий в аспирантуру по химии MSU) и постдокторант Джаясубба Редди Ярава.
Исследование также получило вклад от ведущих микробиологов, включая команду доктора Фредерика Ламота из Университетской больницы Лозанны и Университета Лозанны (Швейцария), доктора Нила А. Р. Гоу из Университета Эксетера (Великобритания) и доктора Пин Вана из Центра медицинских наук Университета штата Луизиана.
Работа также стала возможной благодаря доступу к передовому оборудованию Национальной лаборатории сильных магнитных полей (Таллахасси, Флорида) при технической поддержке доктора Фредерика Ментинк-Вижье и доктора Фейт Скотт.
В конечном итоге исследование не только объясняет, как C. auris выживает при лечении, но и предлагает дорожную карту для разработки более эффективных противогрибковых терапий в будущем, нацеленных на видоспецифичные структурные адаптации.
Дополнительная информация: Malitha C. Dickwella Widanage et al, Distinct echinocandin responses of Candida albicans and Candida auris cell walls revealed by solid-state NMR, Nature Communications (2025). DOI: 10.1038/s41467-025-61678-1
Источник: Michigan State University







0 комментариев