Бактерии выживают после антибиотиков двумя разными способами
Новое исследование показывает, что бактерии могут пережить лечение антибиотиками двумя принципиально разными «режимами отключения», а не только классическим состоянием покоя. Работа опубликована в журнале Science Advances.
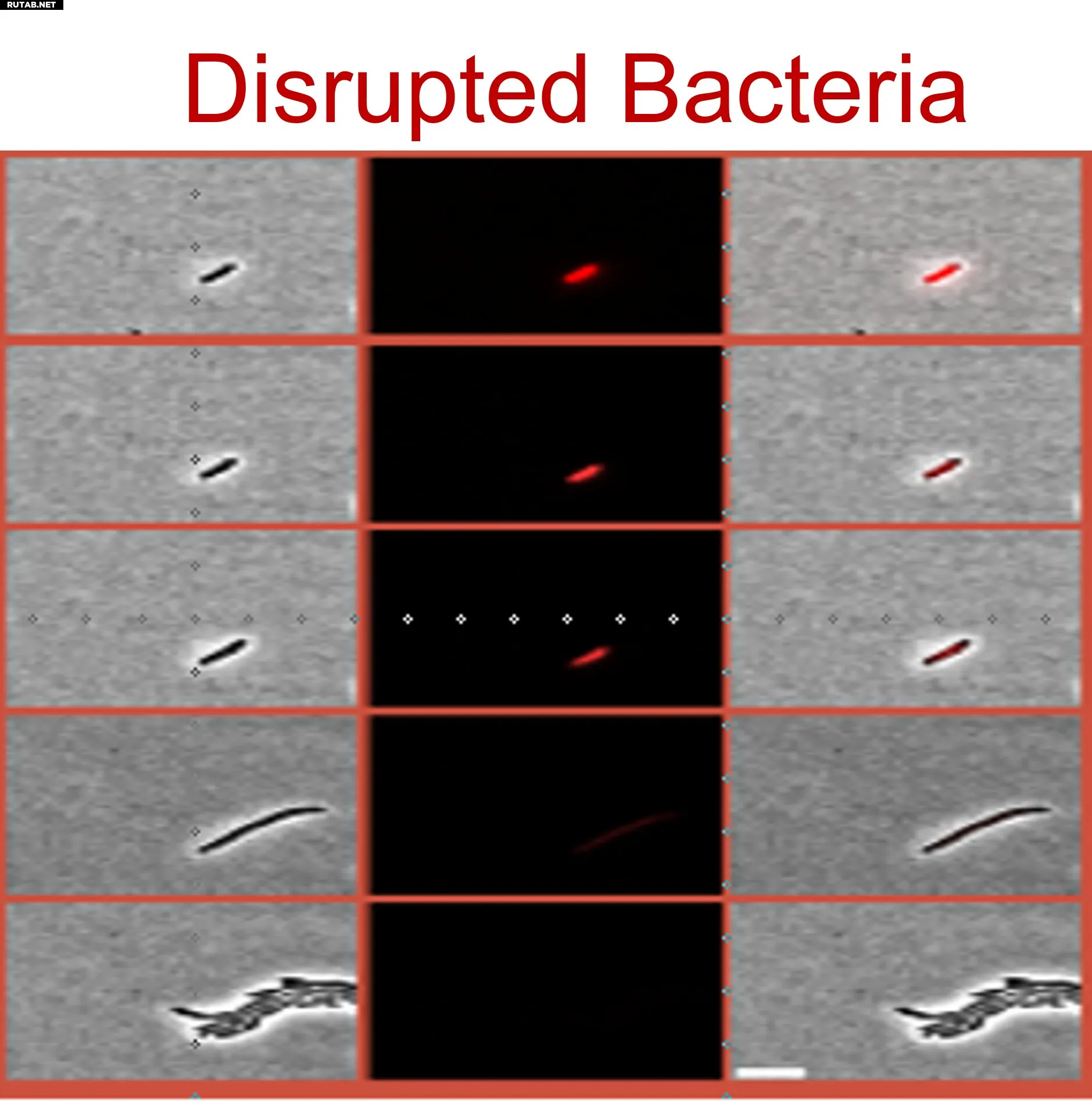
Учёные из Еврейского университета в Иерусалиме под руководством профессора Натали Балабан обнаружили, что одни клетки входят в регулируемую, защитную остановку роста — контролируемое состояние покоя, которое защищает их от антибиотиков. Другие же выживают в нарушенной, нерегулируемой остановке роста — неисправном состоянии, отмеченном уязвимостями, особенно нарушением стабильности клеточной мембраны.
Это различие важно, поскольку персистенция (устойчивость без генетической резистентности) является основной причиной неудач лечения и рецидивирующих инфекций. Ранее считалось, что выживание связано только с состоянием покоя, но новое исследование объясняет противоречивые результаты прошлых работ.
Два «режима выживания»
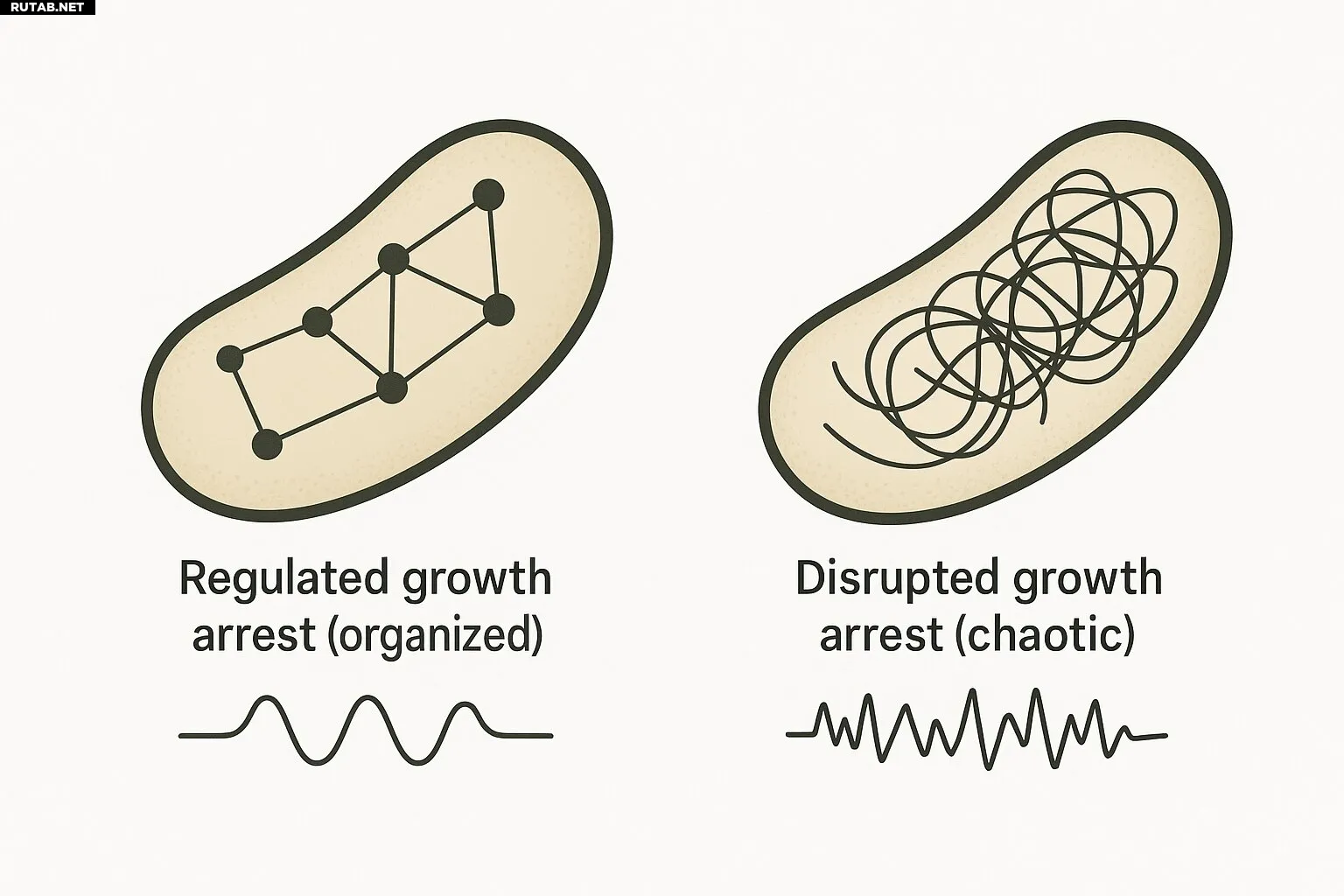
Исследователи выделили два архетипа остановки роста, ведущих к персистенции:
- Регулируемая остановка роста: защищённое состояние покоя. Бактерии намеренно замедляются и входят в стабильное, защищённое состояние.
- Нарушенная остановка роста: выживание через сбой. Это не запланированное отключение, а потеря нормального клеточного контроля. У таких бактерий наблюдается широкое нарушение гомеостаза мембраны — ключевой функции для поддержания целостности клетки. Эта слабость может стать мишенью для лечения.
Перспективы для новых стратегий лечения
Разделение персистенции на два разных физиологических состояния предполагает будущее, в котором методы лечения можно будет адаптировать: по-разному воздействуя на «спящие» и «нарушенные» персистентные клетки.
Для своих выводов команда объединила математическое моделирование с высокоточными экспериментальными методами, включая транскриптомику, микрокалориметрию и микрофлюидику, что позволило наблюдать за отдельными бактериальными клетками.
Больше информации: Adi Rotem et al, Differentiation between regulated and disrupted growth-arrests allows tailoring of effective treatments for antibiotic persistence, Science Advances (2026). DOI: 10.1126/sciadv.adt6577








0 комментариев