Учёные расшифровали, как протеасома человека распознаёт разветвлённые цепи убиквитина
Исследователи из Национального Тайваньского университета впервые с атомарным разрешением выяснили, как человеческий протеасома распознаёт разветвлённые цепи убиквитина. Открытие раскрывает механизм мультивалентного декодирования, который повышает точность и скорость деградации белков.
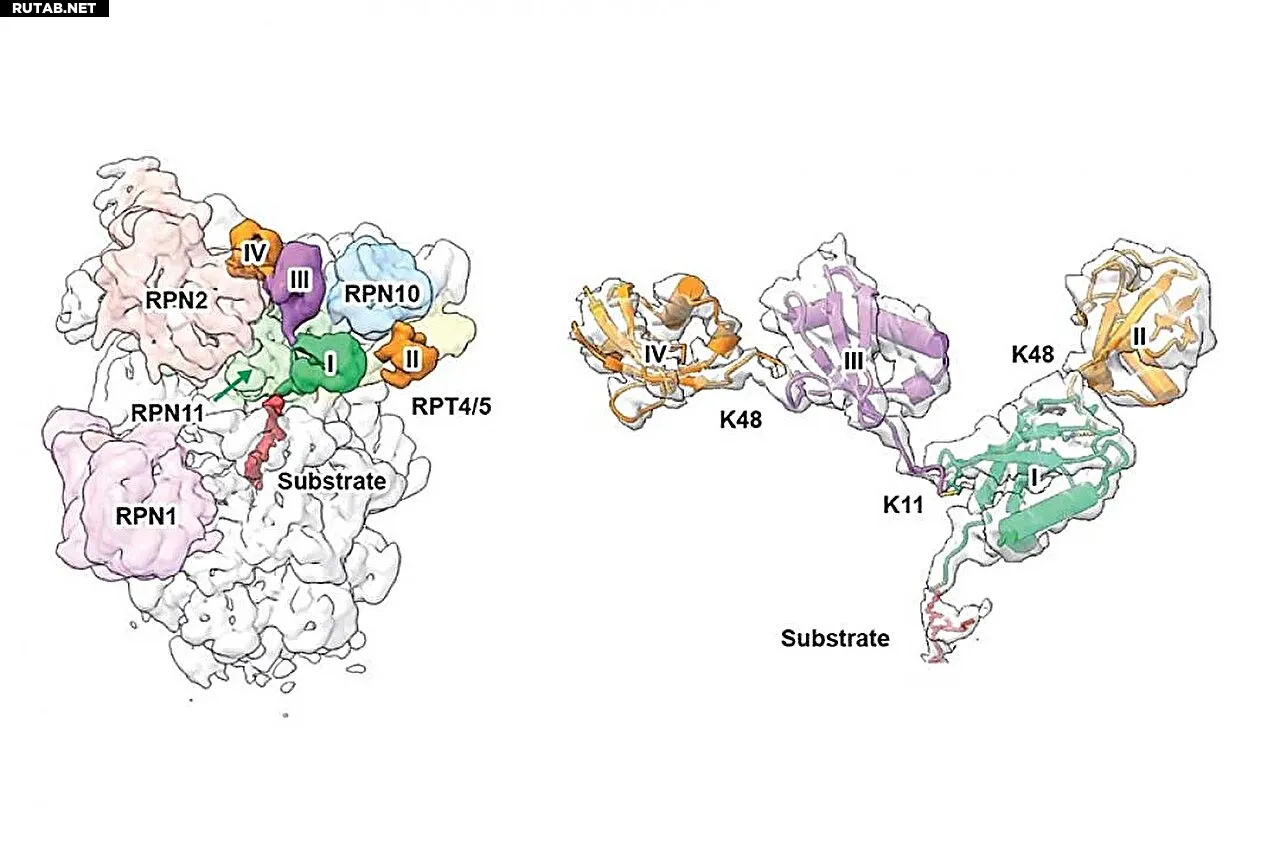
Крио-ЭМ структура разветвлённой цепи убиквитина K11/K48, связанной с регуляторной частицей 19S протеасомы человека 26S. (Слева) Проксимальный убиквитин, убиквитин, связанный по K48, и убиквитин, связанный по K11, окрашены в зелёный, оранжевый и пурпурный цвета соответственно. Указаны субъединицы протеасомы, участвующие в связывании убиквитина. (Справа) Увеличенное изображение разветвлённой тетраубиквитиновой цепи K11/K48 с наложенной картой крио-ЭМ и атомной моделью. Автор: Nature Communications (2025). DOI: 10.1038/s41467-025-64719-x
Работа, опубликованная в журнале Nature Communications, показывает, что субъединица RPN2 регуляторной частицы 19S содержит ранее неизвестный сайт связывания, специфичный для K11-связей. Вместе с другими субъединицами, такими как RPN10, RPN8 и RPT4/5, формируется мультивалентная бороздка, настроенная на цепи убиквитина, связанные по K11. Это потенциально обеспечивает более высокое сродство и специфичность, ускоряя распознавание субстрата и его деградацию.
«Количественная мощность метода Ub-AQUA была важна для этого открытия. Точно измеряя количество различных типов связей убиквитина, исследователи подтвердили как химический состав, так и трёхмерную архитектуру собранных разветвлённых цепей», — говорит профессор Шан-Те Дэнни Хсу, ведущий автор исследования.
Такая стратегия, объединяющая структурный анализ, определение топологии и абсолютную количественную оценку, позволила решить вопрос, который ставил в тупик научное сообщество в течение многих лет.









0 комментариев