Искусственный интеллект научился создавать антитела с нуля
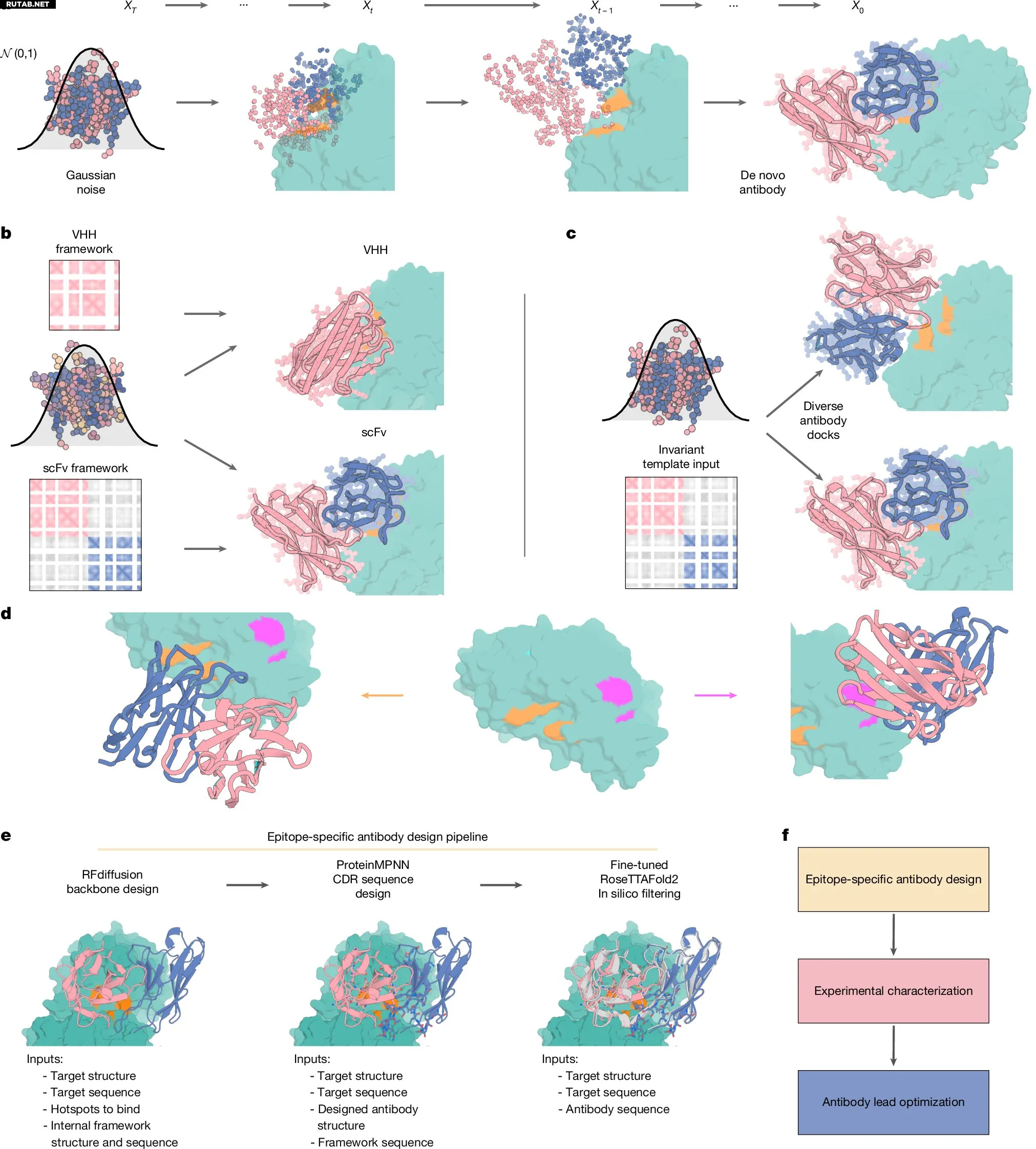
Обзор RFdiffusion для дизайна антител. Автор: Nature (2025). DOI: 10.1038/s41586-025-09721-5
Исследователи из Вашингтонского университета разработали метод на основе искусственного интеллекта, который создаёт антитела, нацеленные на специфические эпитопы — участки молекул вирусов или токсинов. Метод подтверждает атомарно точное связывание с помощью высокоразрешающей молекулярной визуализации и усиливает конструкцию антител для более прочного соединения с мишенью.
Почему важна точная нацеленность
Антитела доминируют в современной терапии — на рынке представлено более 160 препаратов, а прогнозируемая стоимость рынка через 5 лет составит 445 миллиардов долларов США (~35,6 триллионов рублей). Точное соединение антитела с эпитопом определяет, блокирует ли оно инфекцию, маркирует патоген для уничтожения или нейтрализует вредный белок.
Традиционный процесс создания эпитоп-специфичных антител требует многолетней лабораторной работы. Новый вычислительный подход может значительно ускорить и сделать более целенаправленным создание антител, нацеленных на молекулярные поверхности, контролирующие инфекцию, токсичность или клеточную сигнализацию.
В исследовании «Atomically accurate de novo design of antibodies with RFdiffusion», опубликованном в журнале Nature, учёные обучили ИИ-систему создавать антитела, распознающие заданные молекулярные участки.
Модель RFdiffusion использовала информацию о структурах антител и «горячих точках» на поверхности мишени для формирования новых связывающих петель. Вторая сеть, RoseTTAFold2, предсказывала, будет ли каждая конструкция правильно сворачиваться и связываться, отсеивая нестабильные варианты.
Помощь лам в исследованиях
Изначально разработки были сосредоточены на однодоменных антителах VHH. Эти миниатюрные антитела происходят от таких животных, как ламы и альпаки, и ценятся в исследованиях за стабильность, компактность и простоту модификации. Их малый размер позволяет достигать участков на вирусных или бактериальных белках, недоступных для полноразмерных антител.
Исследователи использовали гуманизированную структуру VHH в качестве каркаса и нацелили разработки на гемагглютинин гриппа, токсин B Clostridium difficile, участки I и III RSV и рецептор-связывающий домен SARS-CoV-2.
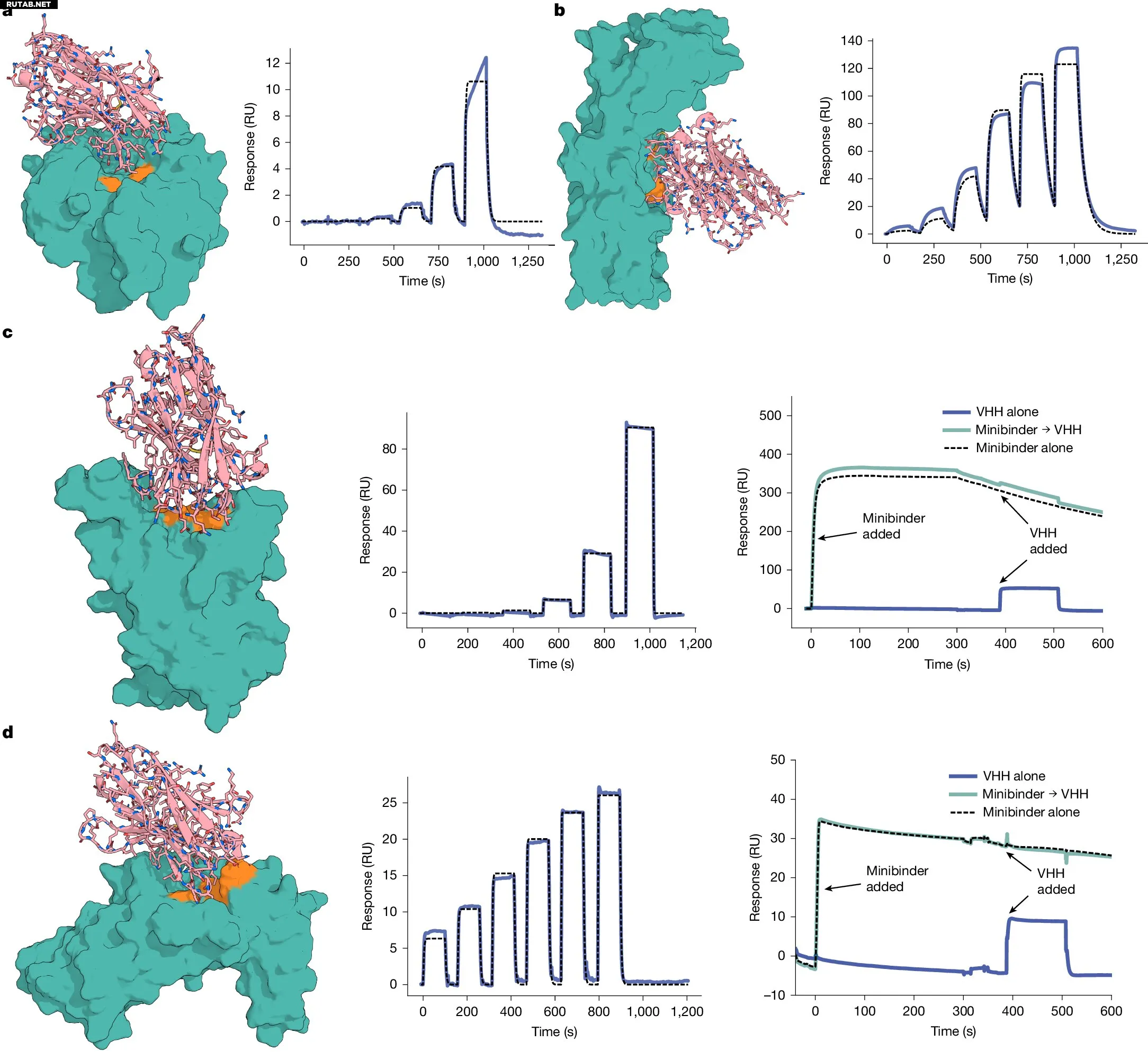
Биохимическая характеристика разработанных VHH. Автор: Nature (2025). DOI: 10.1038/s41586-025-09721-5
Результаты испытаний
Для гриппа были получены несколько лабораторных антител, которые присоединялись к вирусному белку в пробирках. Высокорешительная визуализация показала, что одно из них почти с атомарной точностью соответствует компьютерному плану.
Работа с токсином C. difficile дала компактное антитело, которое захватывало заданный участок и блокировало доступ ранее разработанного конкурента. Лабораторные тесты на клетках показали защиту от повреждений токсином.
Тесты с SARS-CoV-2 создали компактное антитело, которое присоединялось только когда вирусный белок принимал «поднятое» положение и блокировало известного конкурента в этой точке. Однако визуализация показала иной угол подхода, чем планировалось, что авторы назвали неудачей дизайна.
Перспективы технологии
Заявленные показатели успеха пока остаются низкими — от 0% до 2% для разных мишеней. Авторы указывают на улучшенную фильтрацию с помощью AlphaFold3 ipTM как путь к повышению эффективности. Перспективы включают более быстрое и целенаправленное открытие антител по мере улучшения моделей и фильтров.
Больше информации: Nathaniel R. Bennett et al, Atomically accurate de novo design of antibodies with RFdiffusion, Nature (2025). DOI: 10.1038/s41586-025-09721-5
RFdiffusion: github.com/RosettaCommons/RFantibody









0 комментариев