Ученые раскрыли механизм работы фермента, связанного со старением и раком
Ученые из Токийского научного института обнаружили ключевые механизмы работы фермента Sir2, связанного со старением, метаболизмом и подавлением рака. Исследование, опубликованное в Journal of Chemical Information and Modeling, раскрывает «тандемный аллостерический эффект», который обеспечивает эффективный цикл деацетилирования белков.
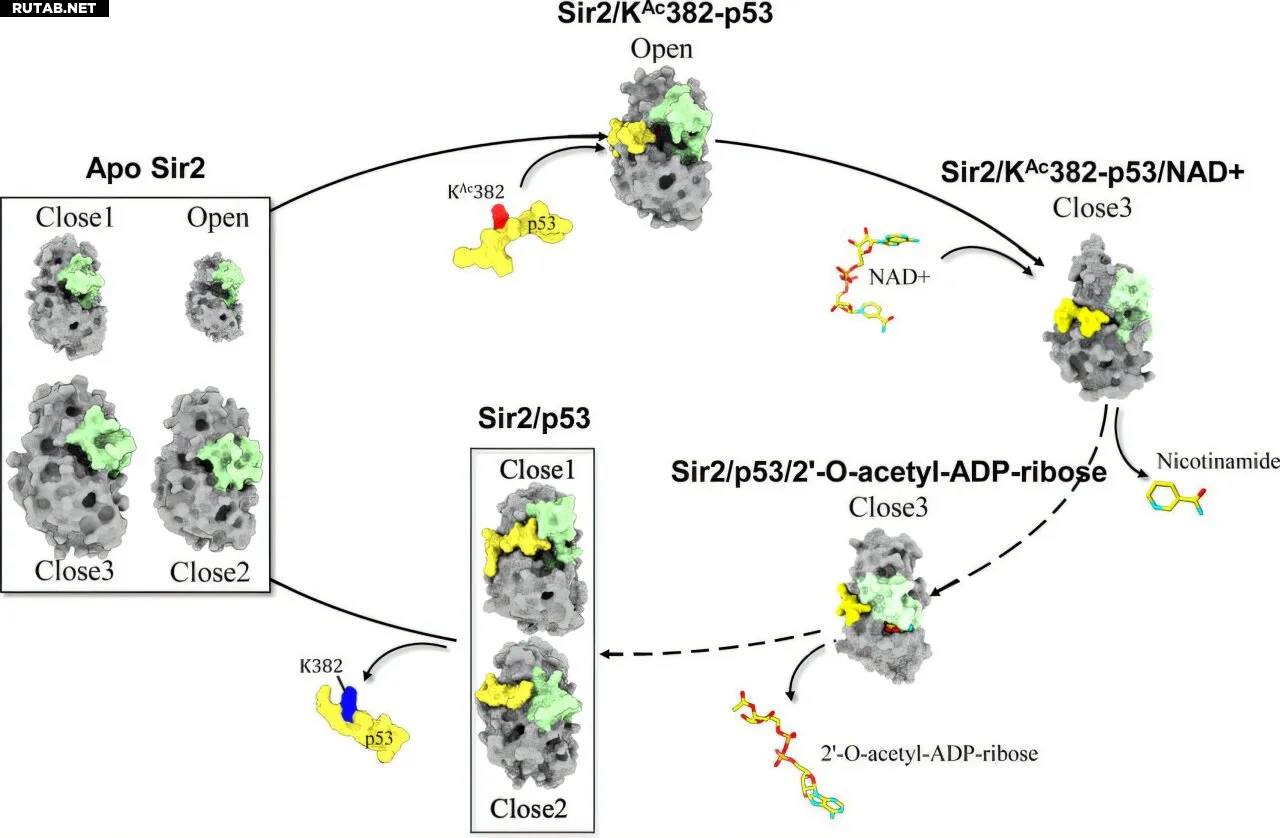
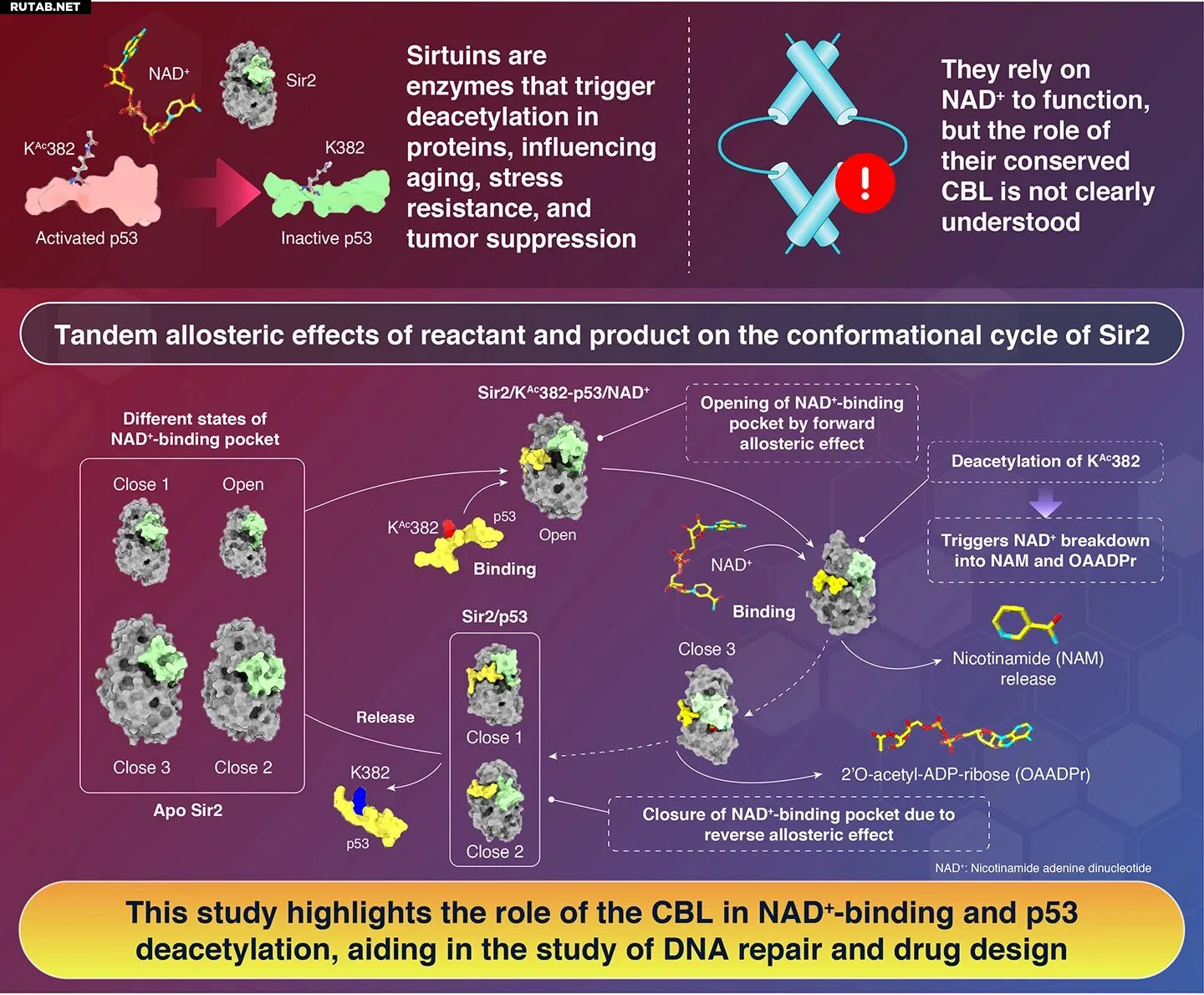
Сиртуины, включая Sir2 и человеческий SIRT1, играют важную роль в физиологических и патологических процессах. Sir2 деацетилирует белки, такие как гистоны и опухолевый супрессор p53, что регулирует их функцию. Ранее было известно, что Sir2 использует ко-субстрат NAD⁺ для реакций деацетилирования, но точная роль гибкого региона CBL оставалась неясной.
С помощью компьютерного моделирования исследователи под руководством профессора Акио Китао выявили, что связывание ацетилированного p53 вызывает аллостерическое изменение в CBL, переводя Sir2 в открытое состояние для эффективного связывания с NAD⁺. После деацетилирования происходит обратный аллостерический эффект, высвобождающий деацетилированный белок и подготавливающий фермент к новому циклу.
«Детальное понимание процесса деацетилирования Sir2 может углубить наши знания о подавлении старения, метаболизме углеводов и липидов, репарации ДНК и поддержать рациональный дизайн лекарств», — поясняет Китао.
Исследователи также показали, что механизм тандаемного аллостерического эффекта сохраняется среди сиртуинов многих видов, включая человека, что указывает на его эволюционную консервативность. Это открытие может привести к новым подходам в терапии рака, направленным на механизмы связывания NAD⁺ в сиртуинах.










0 комментариев