Ученые раскрыли механизм работы бактериального фермента, превращающего токсичный стирол в полезные химикаты
Бактериальный фермент стиреноксид изомераза известен науке более трёх десятилетий, но его механизм действия до сих пор не был расшифрован. «Работать с этим ферментом сложно, потому что он закреплён в мембране бактериальной клеточной системы», — говорит Дирк Тишлер.
В сотрудничестве с Делфтским техническим университетом его команда смогла раскрыть роль аминокислоты тирозина в преобразовании токсичного оксида стирола через редкую перегруппировку Майнвальда. Результаты исследования опубликованы в журнале ACS Catalysis.
Точно настроенная архитектура фермента
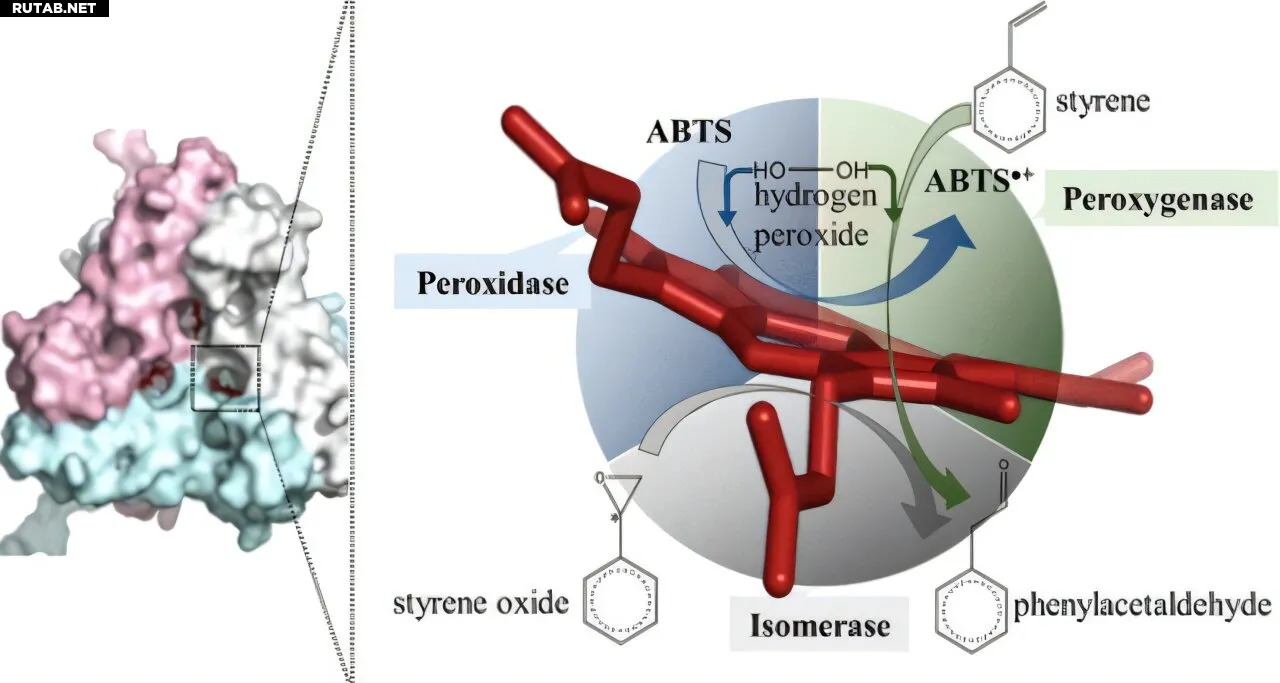
Предыдущие работы по структуре показали, что фермент содержит железосодержащий гем, который запускает реакцию. В текущем исследовании учёные сообщают, что фермент имеет очень строгую архитектуру, состоящую из железосодержащего гема и двух аминокислот — тирозина и аспарагина, — которые точно позиционированы для обеспечения реакции. Путём замены этих аминокислот и использования современных биохимических методов команда смогла показать, что функциональная группа тирозина играет ключевую роль в перегруппировке субстрата.
«Этот крошечный фермент использует редкую химию перегруппировки Майнвальда для селективного производства фенилацетальдегида — контролируемого архитектурой его активного центра», — объясняет Тишлер. «До сих пор каталитическая роль стиреноксид изомеразы была лишь гипотезой. Наша работа предоставляет первые экспериментальные доказательства того, как этот фермент работает на молекулярном уровне», — говорит Селваправин Кумаран, первый автор статьи.
Селваправин Кумаран, аспирант рабочей группы по микробной биотехнологии, проводит измерение в лаборатории. Автор: Дирк Тишлер
Ферментативная универсальность
Понимание каталитического механизма позволило исследователям обнаружить дальнейшие потенциальные применения этого фермента. Стиреноксид изомераза может также использоваться для других целей, подобно ферментам, используемым в текстильной промышленности для отбеливания красителей. Например, она потенциально может детоксифицировать перекись водорода и также производить ценный продукт фенилацетальдегид непосредственно из стирола — предшественника оксида стирола в бактериальном разложении стирола.
Хотя эти дополнительные активности в настоящее время ещё относительно неэффективны, многофункциональность фермента может быть использована в будущем для его дальнейшей разработки специально для промышленных применений и для производства высококачественных продуктов из недорогих субстратов, таких как стирол.
«Потенциал этого фермента выходит далеко за рамки производства фенилацетальдегида — он может запускать множество различных реакций. Именно поэтому мы планируем продолжать исследовать его возможности», — говорит Тишлер.
Дополнительная информация: Selvapravin Kumaran et al, Role of the Active Site Heme and Tyrosine in Styrene Oxide Isomerase's Natural Isomerase and Unnatural Peroxidase and Peroxygenase Activity, ACS Catalysis (2025). DOI: 10.1021/acscatal.5c05395
Источник: Рурский университет Бохума












0 комментариев