Учёные раскрыли механизм ремонта клеточных мембран без затрат энергии
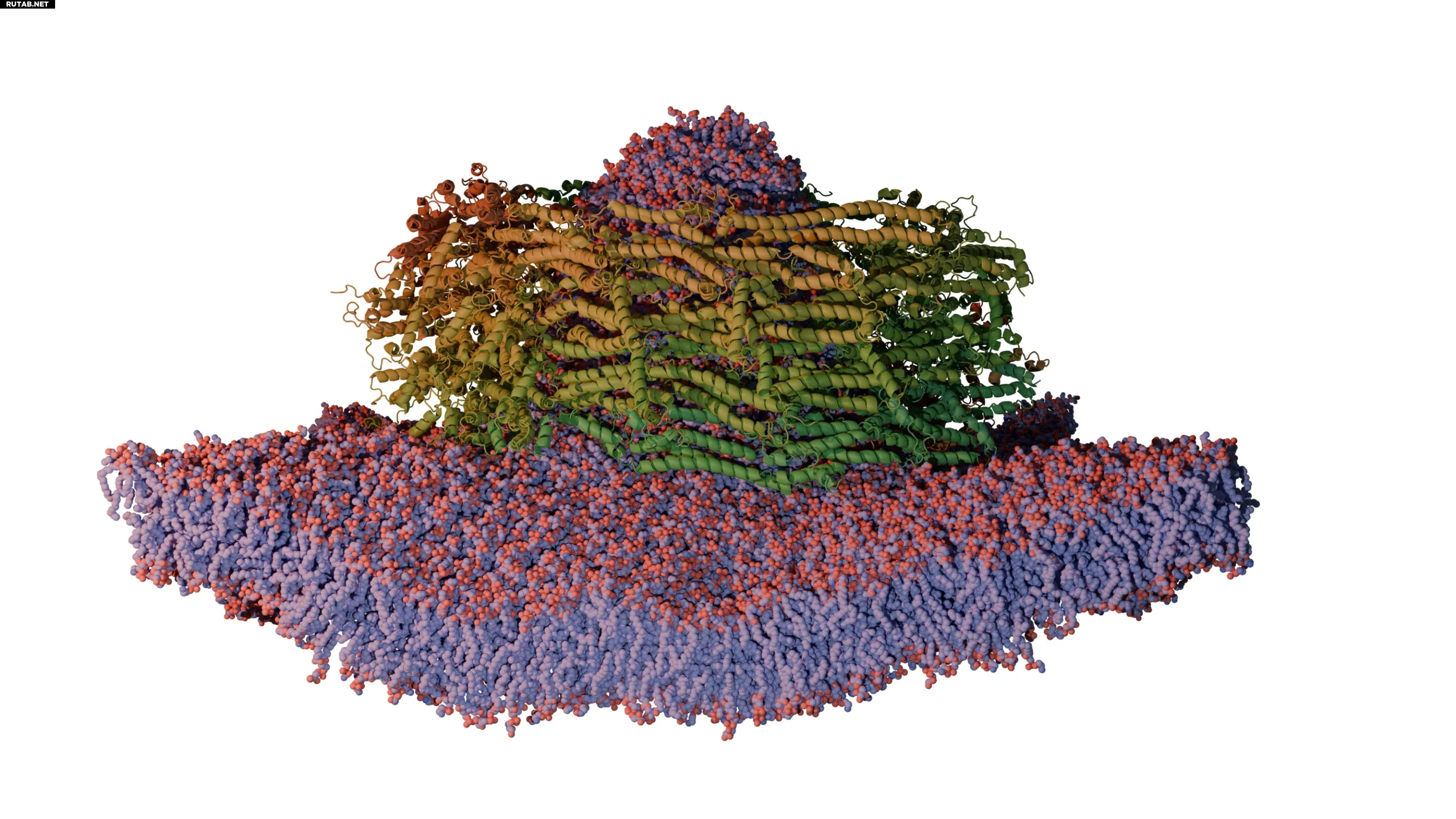
Трубчатый белковый комплекс PspA окружает клеточную мембрану. Автор: Forschungszentrum Jülich / Stephan Schott-Verdugo, Holger Gohlke
Для функционирования жизни клеточные мембраны должны оставаться целыми. Когда эти хрупкие барьеры повреждаются — например, под воздействием тепла или вирусной атаки — на помощь приходят специализированные белки. Исследователи из Forschungszentrum Jülich, Университета Генриха Гейне в Дюссельдорфе и Университета Майнца впервые раскрыли механизм действия одного такого защитного белка PspA, который принадлежит к суперсемейству ESCRT-III.
Их исследование, опубликованное в Proceedings of the National Academy of Sciences, показывает, как белок активно изменяет форму клеточных мембран — без необходимости во внешней энергии. Результаты проливают свет на фундаментальный биологический процесс восстановления.
PspA является частью древнего семейства белков — суперсемейства ESCRT-III — которое формирует мембраны во всех областях жизни. У бактерий PspA помогает защищать внутреннюю мембрану в условиях стресса. Предыдущие работы команды уже показали структурное родство PspA с его эукариотическими аналогами, включая человеческие, и описали его роль в ремонте мембран. Новое исследование добавляет ключевой недостающий элемент.
Комбинируя крио-электронную микроскопию с молекулярно-динамическим моделированием, учёные смогли показать, как PspA собирается в трубчатые белковые комплексы, которые изгибают, сужают и в конечном итоге преобразуют части мембраны в маленькие везикулы.
«В основе процесса лежит крошечная спиральная структура, которая внедряется в поверхность мембраны и деформирует её», — объясняет Эстер Худина из Центра Эрнста Руска для микроскопии и спектроскопии с электронами (ER-C-3) в Forschungszentrum Jülich, одна из первых авторов исследования. Крио-электронная микроскопия в Центре Эрнста Руска предоставила статические снимки молекул в растворе.
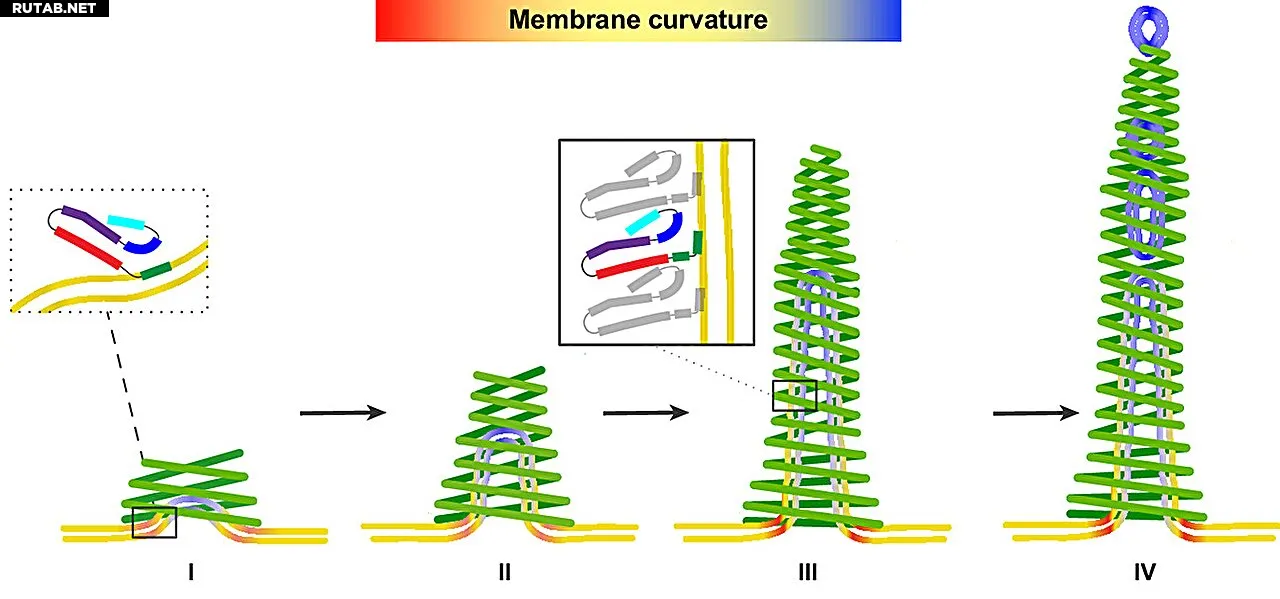
Механизм изменения формы и регенерации мембраны (окраска мембраны иллюстрирует локальную кривизну): I) Белки PspA накапливаются в виде трубок на мембране, II) спиральная структура взаимодействует с мембраной и поставляет дополнительные строительные блоки PspA для её расширения, III) мембрана, заключённая внутри спирали, частично отделяется, IV) маленькие везикулы формируются на узком конце трубки — спонтанный процесс, происходящий без затрат энергии. Автор: Forschungszentrum Jülich / Esther Hudina, Stephan Schott-Verdugo, Benedikt Junglas, Holger Gohlke, Carsten Sachse
«Таким образом, PspA может заключать, изменять форму и отщипывать повреждённые участки мембраны — скорее всего, как часть процесса восстановления», — добавляет биоинформатик доктор Штефан Шотт-Вердуго из Института биологических и геонаук (IBG-4).
Молекулярно-динамическое моделирование на суперкомпьютере JUWELS в Юлихе, проведённое в IBG-4 под руководством профессора Хольгера Голке, который также является профессором Университета Генриха Гейне в Дюссельдорфе, сделало движения молекул видимыми на компьютере. Оно также предоставило модель того, как энергия, необходимая для искривления мембраны, может генерироваться за счёт прогрессирующих взаимодействий спирали с мембраной.
«Мы были поражены тем, что весь этот механизм работает без какого-либо внешнего энергетического вклада», — говорит профессор Карстен Захсе, старший автор и руководитель Центра Эрнста Руска для микроскопии и спектроскопии с электронами в структурной биологии (ER-C-3). «Движущая сила исходит исключительно от связывания белка с мембраной — замечательный биологический трюк».
Помимо углубления нашего базового понимания клеточной биологии, исследование также указывает на потенциальные биотехнологические применения — например, в целенаправленной доставке терапевтических средств с использованием искусственных везикул.
Больше информации: Esther Hudina et al, The bacterial ESCRT-III PspA rods thin lipid tubules and increase membrane curvature through helix α0 interactions, Proceedings of the National Academy of Sciences (2025). DOI: 10.1073/pnas.2506286122
Источник: Jülich Research Centre










0 комментариев