Учёные создали термометр на основе света и звука для уничтожения рака золотыми наночастицами
Синтез и характеристика наночастиц AC-GNS. Автор: Science Advances (2025). DOI: 10.1126/sciadv.adx6350
Биомедицинские инженеры из Университета Дьюка разработали метод более точного нагрева золотых наночастиц для уничтожения раковых опухолей. Используя методы визуализации, сочетающие свет и звук, команда смогла лучше отслеживать и нагревать наночастицы, чтобы уничтожить опухоль мочевого пузыря в модели животного. Исследование опубликовано в журнале Science Advances.
В поисках неинвазивных методов лечения рака световые терапии, такие как фототермическая терапия (PTT) с использованием наночастиц, стали перспективными кандидатами. Во время этих процедур наночастицы, часто имеющие форму стержней или крошечных звёзд, вводятся в организм и перемещаются по кровеносной системе, накапливаясь в раковых опухолях.
Когда достаточное количество наночастиц насыщает опухоль, лазеры используются для их нагрева, что позволяет уничтожить окружающие раковые клетки. PTT с наночастицами уже успешно применялась для лечения рака простаты у людей, и продолжаются дополнительные клинические испытания.
Хотя PTT помогает минимизировать побочные повреждения, которые часто сопровождают световые терапии, у этого подхода есть свои проблемы. Часто при нагреве наночастицы меняют форму, превращаясь из звёзд в сферы, что снижает их эффективность. Исследователям также не хватало инструментов визуализации, способных точно отслеживать температуру и местоположение частиц в глубоких тканях.
«Когда мы хотели измерить температуру, нам приходилось использовать инвазивный термозонд, который был не намного сложнее обычного кухонного термометра», — объяснил Эйдан Каннинг, аспирант лаборатории Туана Во-Динь, профессора биомедицинской инженерии в Университете Дьюка. «Эти зонды также могли поглощать лазерный свет, что искажало показания в глубоких тканях».
Крупный план нанозвезды, созданной Каннингом, которая использует полую золотую оболочку для стабилизации «лучей» звезды. Автор: Science Advances (2025). DOI: 10.1126/sciadv.adx6350
Но Каннинг нашёл решение этих давних проблем буквально в нескольких лабораториях от своей — в Университете Дьюка.
Три Ву, аспирант лаборатории Цзюньцзе Яо, работал над фотоакустической томографией — методом визуализации, который включает в себя облучение ткани лазером и измерение возникающей ультразвуковой волны для создания цветных изображений. Ву разрабатывал кольцевую систему для визуализации мелких животных, которую назвал фотоакустической компьютерной томографией (PACT).
«Это похоже на миниатюрный аппарат МРТ, — пояснил Ву, ныне доцент Университета Оклахомы. — Но когда животное, например мышь, помещается в систему, мы можем получить изображение глубоких тканей по всему телу».
Каннинг узнал о технологии Ву и заинтересовался, как она сочетается с его нанозвёздами. Ву тоже был заинтригован. В первых экспериментах команда обнаружила, что система визуализации Ву легко отслеживает накопление нанозвёзд Каннинга в целевых опухолях и тканях животных.
Они также выяснили, что тепловая чувствительность фотоакустической визуализации позволяет точнее измерять температуру нанозвёзд и окружающих тканей.
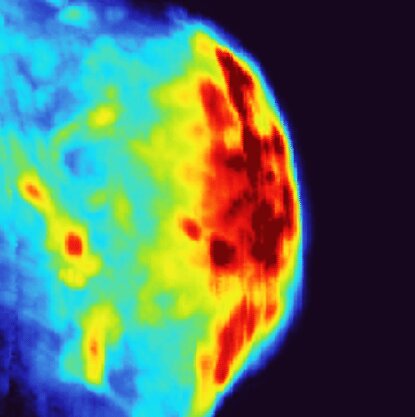
Красный цвет на фотоакустическом изображении показывает, где накопились золотые нанозвёзды в опухоли мочевого пузыря. Автор: Science Advances (2025). DOI: 10.1126/sciadv.adx6350
Каннинг и Ву проверили эффективность своей системы на модели рака мочевого пузыря у мышей, используя усовершенствованную версию золотых нанозвёзд. Новый дизайн Каннинга заключает каждую нанозвезду в полую золотую оболочку, которая стабилизирует её «лучи» при нагреве, предотвращая превращение в сферы.
В сочетании с системой PACT Ву команда легко смогла обнаруживать и визуализировать нанозвёзды, а также контролировать процесс фототермического лечения. Благодаря более точному мониторингу температуры исследователи определили оптимальную дозу нагрева для активации нанозвёзд и уничтожения клеток.
Комбинация этих технологий привела к 100% выживаемости в моделях рака мочевого пузыря, при этом не наблюдалось токсичности или повреждения поверхностных тканей.
«Интеграция этих технологий стала важным шагом в решении проблем этой области и разработке более персонализированного лечения», — сказал Каннинг.
Дуэт уже планирует продолжить работу, исследуя, как эти инструменты работают на более крупных животных моделях. Они также надеются изучить, как можно комбинировать PTT с другими методами лечения, такими как иммунотерапия, для оптимизации противоракового иммунного ответа.
«Эта работа открывает множество возможностей для изучения новых способов улучшения фототермической терапии с помощью фотоакустической визуализации, — сказал Ву. — Мы с Эйданом благодарны нашим лабораториям и Университету Дьюка за создание среды, в которой такое сотрудничество стало возможным».
Подробнее: Aidan J. Canning et al, Advancing precision photothermal therapy by integrating armored gold nanostars with real-time photoacoustic thermometry and imaging, Science Advances (2025). DOI: 10.1126/sciadv.adx6350
Источник: Duke University











0 комментариев