Учёные раскрыли атомную структуру ключевого митохондриального фермента
Исследователи из Каролинского института впервые получили детальные молекулярные «снимки» человеческой полинуклеотидфосфорилазы (hPNPase) в действии. Этот фермент играет ключевую роль в контроле качества РНК в митохондриях, а его мутации вызывают тяжёлые наследственные заболевания.
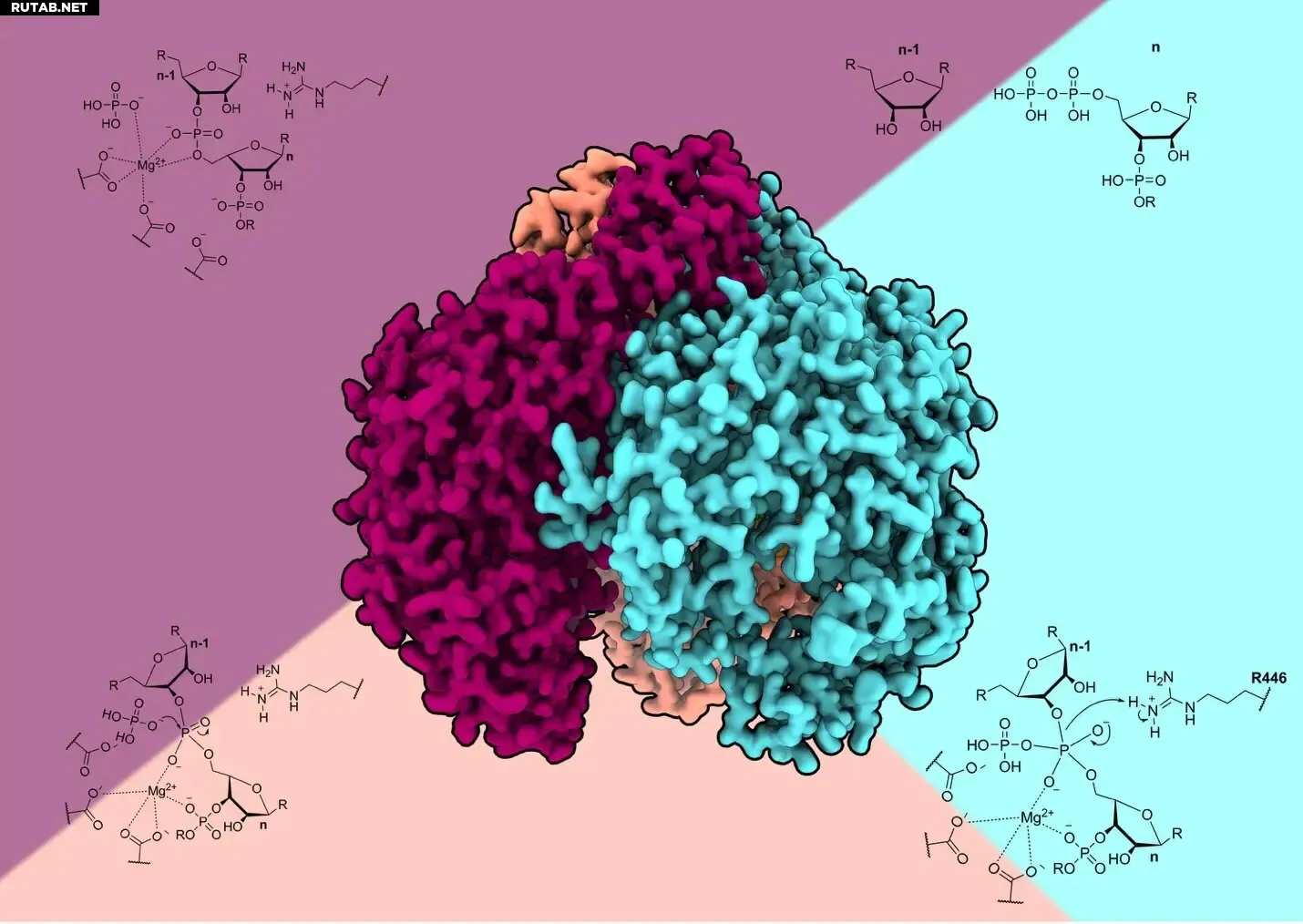
Крио-электронная реконструкция человеческой PNPase и схема механизма реакции. Автор: Оле Унсельд
Используя крио-электронную микроскопию, команда зафиксировала фермент в трёх функциональных состояниях, создав «молекулярное кино» деградации РНК с почти атомарным разрешением. Оказалось, что hPNPase использует изящный двухэтапный механизм с «выворачиванием» (flipping) нуклеотидного основания на 180 градусов для точного разрезания РНК.
«Мы были удивлены, обнаружив, что фермент использует выворачивание основания, чтобы контролировать, где и когда он разрезает РНК», — говорит первый автор исследования, аспирант Оле Унсельд.
Структуры также показали, что ион магния играет двойную каталитическую роль, а одноцепочечная РНК проникает в активный центр фермента не через центральную пору, как у бактериальных аналогов, а снизу. Это стало неожиданным открытием.
«Гибкие петли, которые закрывают пору, не просто блокируют вход РНК, они активно регулируют активность фермента, стабилизируя активный центр, когда РНК связана. Это представляет собой эукариотическую адаптацию», — объясняет руководитель исследования Мартин Халльберг.
Полученные данные имеют прямое отношение к пониманию человеческих болезней. Мутации в гене PNPT1, кодирующем hPNPase, вызывают синдром Ли (тяжёлое прогрессирующее неврологическое расстройство), наследственную потерю слуха и дефицит дыхательной цепи. Новые структурные модели позволяют предсказывать, какие именно мутации нарушат работу фермента, что важно для генетического консультирования.
Исследование открывает новые направления для изучения, в том числе взаимодействие hPNPase с митохондриальной хеликазой hSuv3 в составе более крупного комплекса — деградасомы.
Больше информации: Ole Unseld et al, Loop-mediated regulation and base flipping drive RNA cleavage by human mitochondrial PNPase, Nucleic Acids Research (2025). DOI: 10.1093/nar/gkaf1296







0 комментариев