Белок RfaH помогает бактериям выживать в организме и избегать лечения
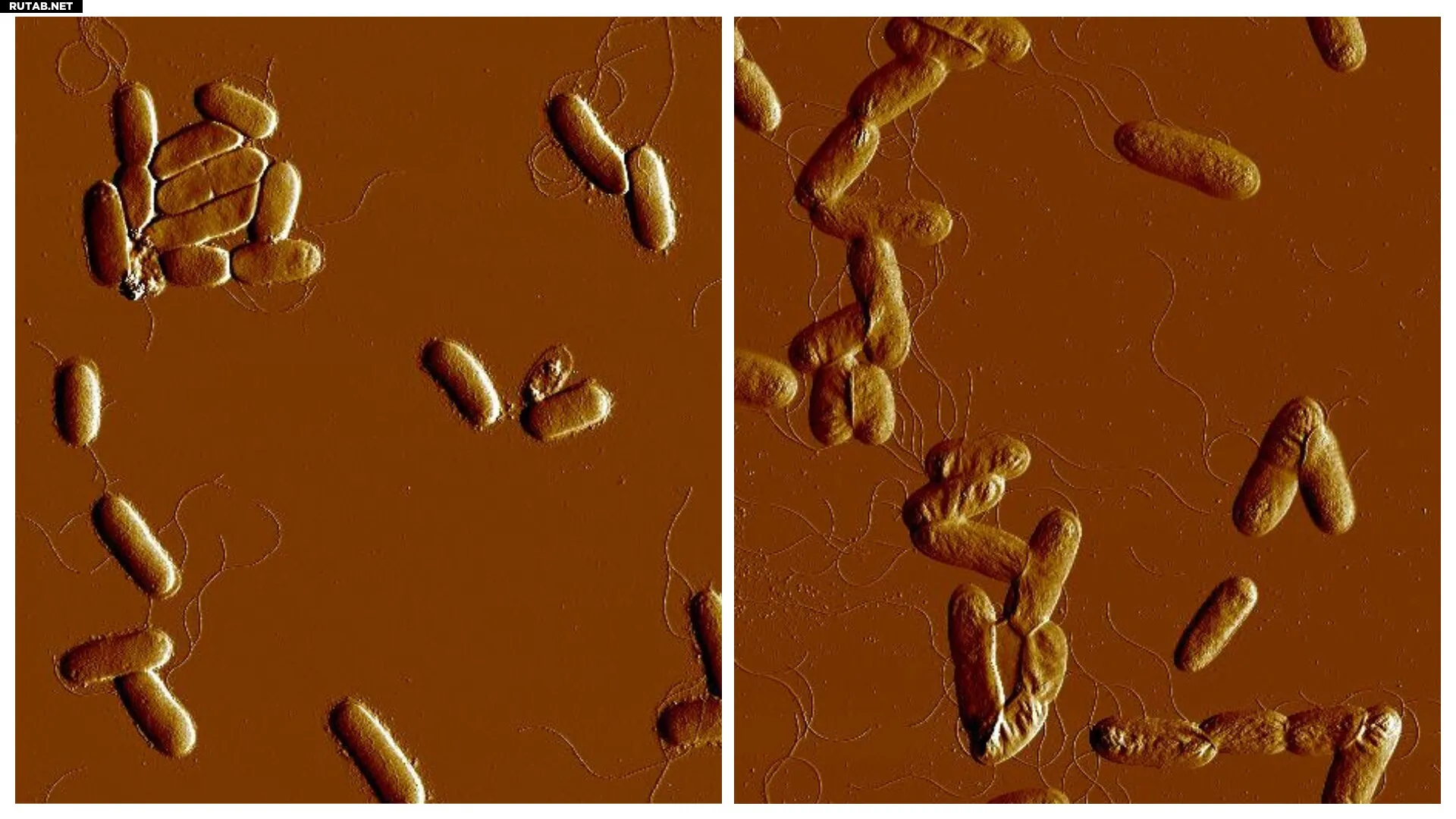
Снимки атомно-силовой микроскопии клеток Yersinia pseudotuberculosis, лишённых белка RfaH, в условиях высокой солёности. Отсутствие RfaH приводит к дефектам поверхности бактерий, заставляя их слипаться в стрессовой среде. Автор: Кемаль Авиджан
Исследователи из Умеоского университета обнаружили ключевой молекулярный механизм, помогающий бактериям выживать в агрессивной среде человеческого организма. Исследование, опубликованное в журнале mBio, показывает, как белок RfaH действует как защитный щит для бактериальных генов и указывает на новые стратегии борьбы с персистирующими инфекциями.
«Человеческое тело — очень стрессовое место для бактерий», — говорит Кемаль Авиджан, руководитель исследовательской группы. «Во время инфекции иммунная система атакует, питательных веществ не хватает, а микробы подвергаются воздействию желчных солей, кислот и высокой температуры. Мы изучили, как RfaH помогает бактериям справляться с этим стрессом, включая нужные гены выживания в нужное время».
Используя Yersinia pseudotuberculosis в качестве модели, команда показала, что RfaH необходим для бактериальной персистенции. Белок действует как «молекулярный телохранитель», предотвращая преждевременное прекращение транскрипции — процесса копирования ДНК в матричную РНК.
Кемаль Авиджан и Джорам Кирига Вайтиту в лаборатории. Автор: Габриэль Бинс
«Когда мы удалили RfaH, способность бактерий устанавливать долгосрочную инфекцию резко снизилась!» — добавляет Авиджан.
В экспериментах на мышах разница была разительной: почти все животные заражались нормальными бактериями, но только около одного из пяти заражались бактериями без RfaH. Это привело к значительно более высоким показателям выживаемости среди мышей.
RfaH контролирует производство ключевого компонента поверхности бактерий — O-антигена. Без RfaH этот внешний слой становится дефектным. Влияние RfaH распространяется дальше, активируя многие «нижележащие» гены, участвующие в прикреплении, движении и транспорте питательных веществ.
«Этот антимикробный подход может обезвредить патогенные бактерии, не нарушая работу полезных», — говорит Джорам Кирига Вайтиту, первый автор исследования.
Хотя Yersinia pseudotuberculosis обычно вызывает у людей инфекцию, которая может пройти самостоятельно, она служит ценной моделью для изучения кишечных бактерий, способных вызывать длительные или рецидивирующие заболевания, такие как Escherichia coli, Salmonella и Helicobacter.
Результаты исследования могут открыть путь к новым стратегиям борьбы с трудноизлечимыми кишечными инфекциями.







0 комментариев