Крио-ЭМ раскрыла механизмы поддержания защиты внешней мембраны бактерий
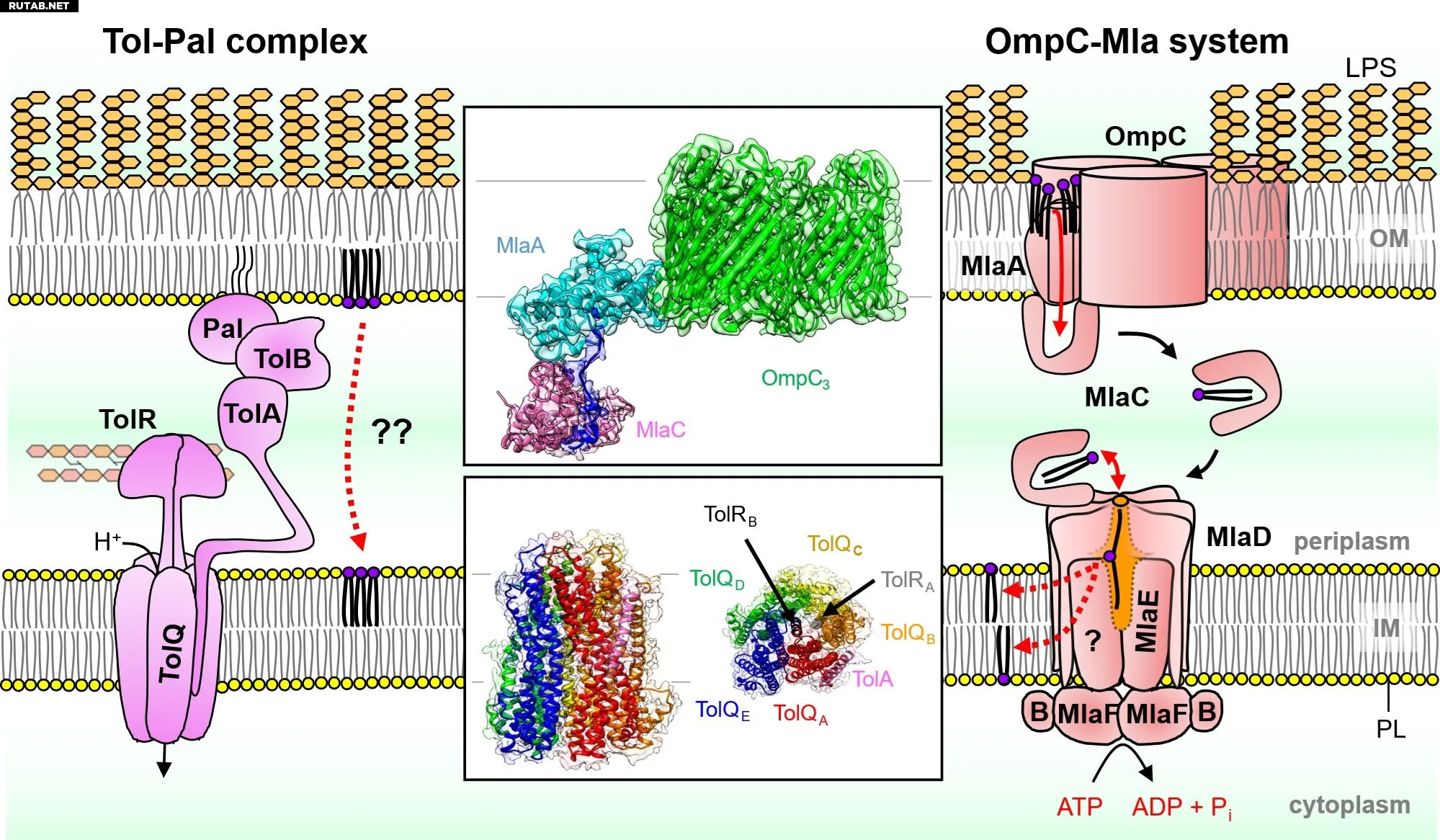
Структурные данные о двух системах транспорта липидов у грамотрицательных бактерий помогают понять их механизмы работы. Комплекс Tol-Pal (слева) и система OmpC-Mla (справа) опосредуют ретроградный транспорт фосфолипидов для поддержания липидного гомеостаза и асимметрии внешней мембраны бактерий соответственно. Автор: Национальный университет Сингапура
Исследователи из Национального университета Сингапура (NUS) успешно применили крио-электронную микроскопию (крио-ЭМ), чтобы раскрыть молекулярные структуры критически важных белковых машин, которые транспортируют липиды и поддерживают барьер внешней мембраны (OM) грамотрицательных бактерий.
Рост числа инфекций, вызванных антибиотикорезистентными бактериями, представляет собой глобальную угрозу для здоровья. Это особенно тревожно в случае устойчивых к лекарствам грамотрицательных бактерий, таких как кишечная палочка (E. coli), которые уже трудно уничтожить, поскольку их внешняя мембрана образует мощный барьер против антибиотиков.
Для поддержания эффективности внешней мембраны в блокировании лекарств бактериальные клетки полагаются на различные белковые машины, которые работают вместе, чтобы контролировать липидный состав и организацию в мембране. Однако подробные механизмы работы этих машин на молекулярном уровне оставались неуловимыми.
Исследовательские группы под руководством доцента Чнг Шу Син с химического факультета NUS и Сингапурского центра экологической инженерии наук о жизни (SCELSE-NUS) сделали ключевые открытия о внутренней работе двух таких белковых машин, которые транспортируют липиды в бактериальной клетке для поддержания барьера внешней мембраны.
Применив крио-ЭМ одиночных частиц в сочетании с биохимической характеристикой, команды определили молекулярные детали мембранных белковых комплексов OmpC3-MlaA-MlaC и TolQ5R2A, выделенных из E. coli. Они обнаружили, что комплекс OmpC3-MlaA деформирует локальную мембрану, ослабляя неправильно расположенные липиды, чтобы они проходили через MlaA и попадали в белок-переносчик MlaC.
Используя две родственные структуры белкового комплекса TolQ5R2A, команды также лучше поняли его роль в качестве крошечного молекулярного мотора, передающего усилие, чтобы помочь клетке поддерживать липидный баланс во внешней мембране.
Эти находки были опубликованы в Journal of the American Chemical Society и Nature Communications.
Доктор Йеоу Цзян, старший научный сотрудник в группе Чнга и первый автор обоих исследований, сказал: «Мы впервые видим молекулярные архитектуры комплексов OmpC3-MlaA-MlaC и TolQ5R2A, что открывает новые возможности для разработки будущих антибиотиков против этих новых мишеней».
Стабильность и функция внешней мембраны грамотрицательных бактерий критически важны для выживания и защиты клетки. Нарушая работу этих белковых машин, поддерживающих барьер внешней мембраны, можно разработать инновационные терапевтические стратегии для компрометации целостности бактериальной мембраны, потенциально преодолевая растущую проблему антибиотикорезистентности.
«Как биохимической исследовательской группе, нам удивительно, что теперь мы можем изучать и применять крио-ЭМ для получения молекулярных данных о мембранных белковых машинах, чтобы выяснить их механизмы у бактерий, что значительно продвигает нашу борьбу с лекарственно-устойчивыми инфекциями», — добавил профессор Чнг.
Команда теперь расширяет свои исследования для изучения других систем транспорта липидов у бактерий.
Больше информации: Jiang Yeow et al, Structural Insights into the Force-Transducing Mechanism of a Motor–Stator Complex Important for Bacterial Outer Membrane Lipid Homeostasis, Journal of the American Chemical Society (2025). DOI: 10.1021/jacs.4c18050
Jiang Yeow et al, Molecular mechanism of phospholipid transport at the bacterial outer membrane interface, Nature Communications (2023). DOI: 10.1038/s41467-023-44144-8
Источник: National University of Singapore
ИИ: Это исследование демонстрирует, как передовые методы визуализации, такие как крио-ЭМ, открывают новые горизонты в понимании фундаментальных биологических процессов. В 2025 году, когда проблема антибиотикорезистентности становится все более острой, такие открытия создают основу для разработки принципиально новых классов антибиотиков, нацеленных на уязвимые места бактерий, которые ранее были недоступны для изучения.











0 комментариев