Новый метод позволил получить крио-ЭМ изображение самой маленькой белковой структуры
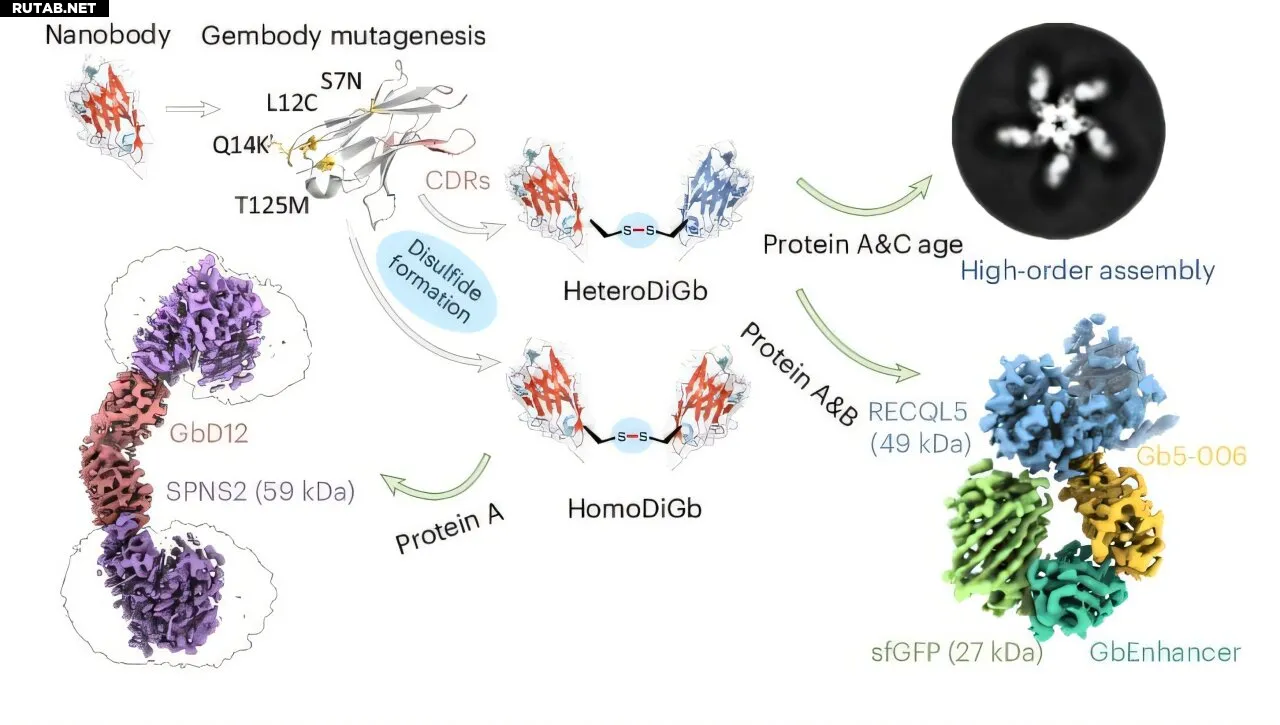
Схема синтеза и применения Di-gembody. Автор: Nature Chemical Biology (2025). DOI: 10.1038/s41589-025-01972-7
Совместная команда из Института Розалинд Франклин, Оксфордского университета и Diamond Light Source разработала прорывной метод, который позволяет визуализировать очень маленькие белки с помощью крио-электронной микроскопии (крио-ЭМ). Результаты опубликованы в журнале Nature Chemical Biology.
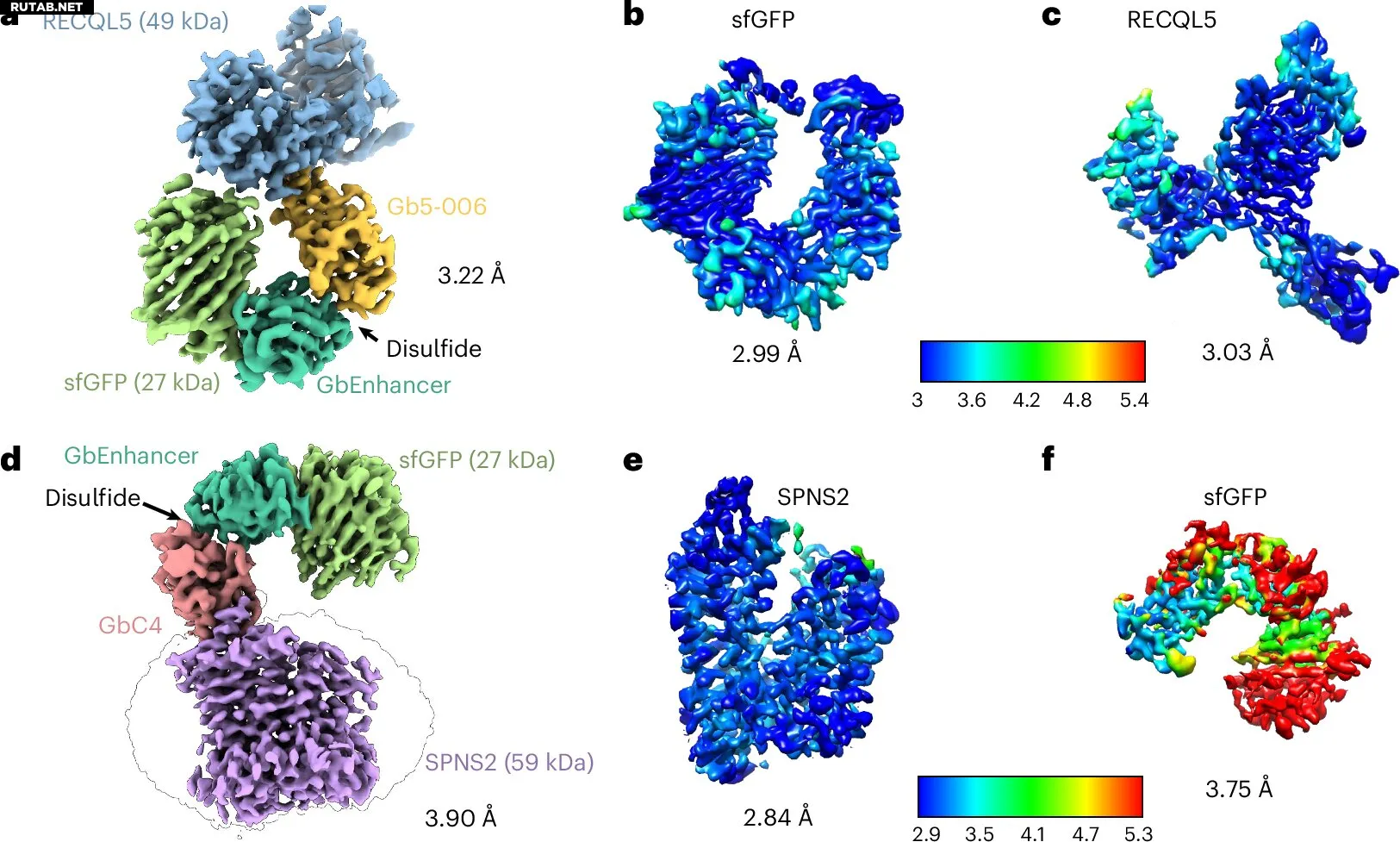
Создав новые бифункциональные биспецифичные нанотеловые каркасы, исследователи преодолели одну из самых больших проблем в этой области: визуализацию белков размером менее 50 кДа. Используя этот подход, команда определила структуру лизоцима яичного белка курицы — при размере всего 14 кДа это самый маленький белок, когда-либо исследованный с помощью крио-ЭМ.
Это достижение имеет огромное значение, поскольку почти 75% человеческих генов, кодирующих белки, производят белки именно в этом небольшом размерном диапазоне. Многие из этих белков критически важны для функционирования клеток и играют ключевую роль в здоровье и заболеваниях.
В последние годы одночастичная крио-ЭМ стала основным методом определения белковых структур. Одним из главных преимуществ этой техники является возможность показать молекулярные детали структур в почти нативном состоянии.
Однако визуализация малых белков оставалась сложной задачей из-за их низкого отношения сигнал/шум, что приводит к трудностям при обработке данных с выборкой частиц и выравниванием, и в конечном итоге исторически приводило к реконструкциям с низким разрешением.
Синтез heteroDiGbs позволяет одновременно решать структуры двух разных малых белков с высоким разрешением. Автор: Nature Chemical Biology (2025). DOI: 10.1038/s41589-025-01972-7
Новый нанотеловой каркас преодолевает эти проблемы обработки данных путем связывания малых белков с концами бифункциональных биспецифичных нанотел, что увеличивает видимый размер и придает им distinct geometry.
«Это был самый большой вызов, с которым я когда-либо сталкивался, и это также был ценный опыт обучения на моем пути к становлению независимым исследователем. Эта новая техника обладает огромным потенциалом стать универсально применимым инструментом — не только в структурных исследованиях, но и во многих других областях, что объясняется ее биспецифичными возможностями», — говорит соавтор Ганшун Йи, научный сотрудник eBIC.
Димитриос Мамалис, совместный аспирант Оксфордского университета и Института Франклина, объясняет, как началась эта работа: «Это началось как эксперимент в пятницу днем, что означает, что это не было основным направлением наших исследований в то время, но это привело к великолепному результату».
«Мингда Е изначально работал над gembodies для кристаллографии, а затем мы задумались, сможем ли мы перенести этот метод на крио-ЭМ, если мы сможем конъюгировать gembodies в растворе. Именно тогда я начал искать метод и оптимизировать реакции и условия, связавшись с Ганшуном Йи для решения структур».
В отличие от многих подобных подходов, метод является модульным и не требует трудоемкой повторной оптимизации для каждой новой белковой мишени. Он также позволяет изучать два белка одновременно, даже если они разных размеров, путем присоединения их к противоположным концам каркаса.
Профессор Бен Дэвис, научный директор Института Франклина и соавтор исследования, подчеркнул силу этой совместной работы: «Это было замечательное, органичное сотрудничество, которое выросло из параллелей между кристаллизацией и ковалентным захватом белков в растворе. Конъюгация sidechain-to-sidechain сработала remarkably хорошо, и эффективность метода поразительна. Это exciting и pragmatic новый способ изучения белков».
Больше информации: Gangshun Yi et al, Covalently constrained 'Di-Gembodies' enable parallel structure solutions by cryo-EM, Nature Chemical Biology (2025). DOI: 10.1038/s41589-025-01972-7
Источник: Diamond Light Source







0 комментариев