Новая технология CRISPR может революционизировать лечение генетических заболеваний
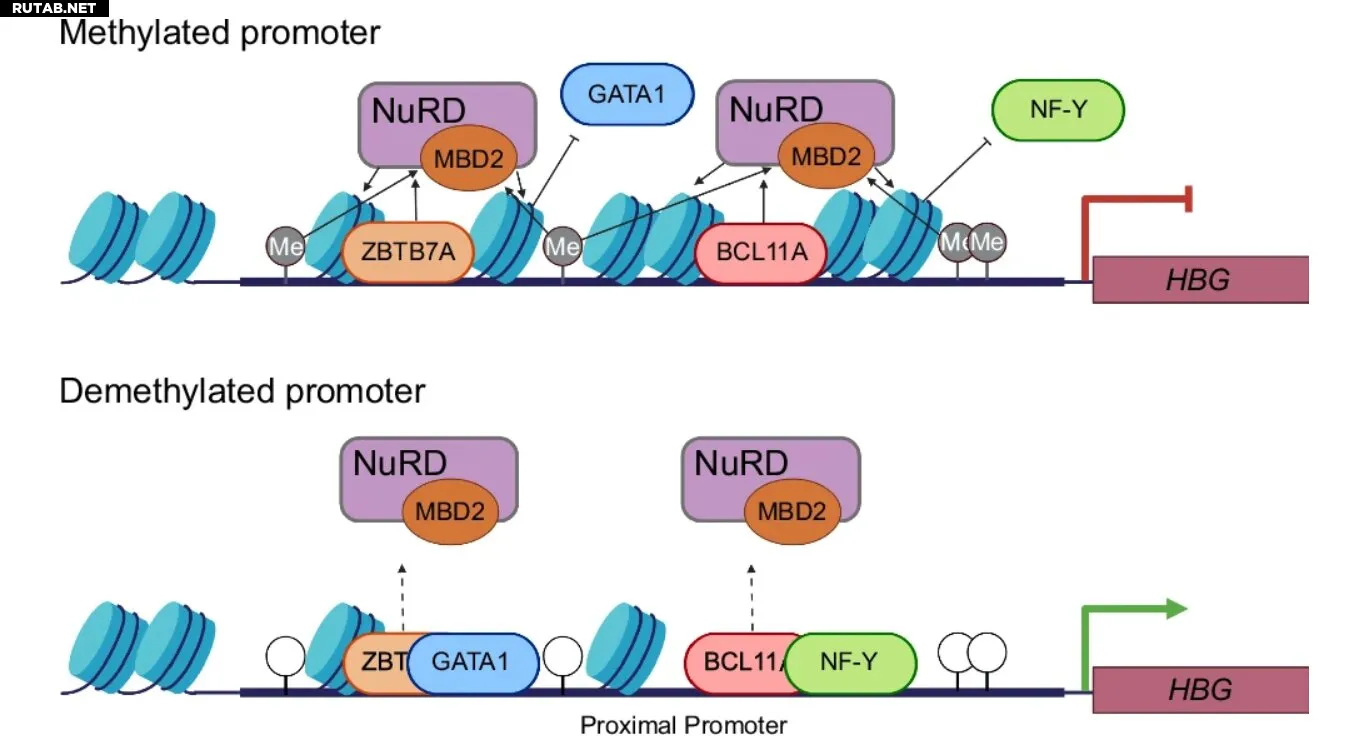
Модель репрессии генов HBG через метилирование CpG-сайтов промотора. Автор: Nature Communications (2025). DOI: 10.1038/s41467-025-62177-z
Новое поколение технологии CRISPR, разработанное в Университете Нового Южного Уэльса (UNSW Sydney), предлагает более безопасный путь лечения генетических заболеваний, таких как серповидноклеточная анемия. Исследование также окончательно доказало, что химические метки на ДНК — ранее считавшиеся просто «генетической паутиной» — активно подавляют гены.
Десятилетиями ученые спорили, являются ли метильные группы — небольшие химические кластеры, накапливающиеся на ДНК — просто «мусором» в неактивных участках генома или же они напрямую ответственны за подавление генов. Теперь исследователи из UNSW совместно с коллегами из Детского исследовательского госпиталя Сент-Джуд (Мемфис, США) доказали в статье, опубликованной в Nature Communications, что удаление этих меток может реактивировать гены.
«Мы четко показали: если убрать "паутину", ген включается», — говорит ведущий автор исследования профессор Мерлин Кроссли, заместитель вице-канцлера UNSW по академическому качеству. «А когда мы добавляли метильные группы обратно, гены снова выключались. Так что это не паутина — это якоря».
Краткая история CRISPR
CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) — основа технологии редактирования генов, позволяющей ученым находить и исправлять дефектные участки ДНК. Первое поколение CRISPR работало по принципу «разрезания» ДНК, второе — точечного редактирования генетического кода. Однако оба подхода связаны с риском нежелательных мутаций.
Третье поколение — эпигенетическое редактирование — фокусируется на химических метках (метильных группах) на поверхности генов. Вместо разрезания ДНК этот метод удаляет метильные группы с «заглушенных» генов, реактивируя их.
Серповидноклеточная анемия
Новый метод может помочь в лечении серповидноклеточной анемии — генетического заболевания, вызывающего деформацию эритроцитов. Вместо разрезания ДНК модифицированная система CRISPR доставляет ферменты, удаляющие метильные группы. Это позволяет «разбудить» фетальный ген глобина, который в норме активен только у плода, но может компенсировать дефектный взрослый ген глобина.
«Фетальный ген глобина — как тренировочные колеса на детском велосипеде», — объясняет профессор Кроссли. «Мы можем заставить их снова работать у тех, кому нужны новые "колеса"».
Перспективы
Пока метод тестировался только на клетках в пробирках. Соавтор исследования профессор Кейт Куинлан отмечает, что эпигенетическое редактирование может быть применено и к другим генетическим заболеваниям, избегая рисков, связанных с разрезанием ДНК.
В ближайшие годы исследователи планируют испытать метод на животных моделях. «Это только начало новой эры», — говорит профессор Кроссли.
Дополнительная информация: Henry W. Bell et al, Removal of promoter CpG methylation by epigenome editing reverses HBG silencing, Nature Communications (2025). DOI: 10.1038/s41467-025-62177-z





0 комментариев