Наноархитектура взаимодействия антител с рецепторами раскрыта с помощью суперразрешающей микроскопии
Исследование структуры и функции терапевтических антител против CD20 с помощью микроскопии RESI. Автор: Nature Communications (2025). DOI: 10.1038/s41467-025-61893-w
Новое исследование демонстрирует, как организация рецепторов на уровне отдельных молекул в клеточном контексте определяет функцию антител, открывая новые пути для разработки иммунотерапий рака.
Терапевтические антитела произвели революцию в лечении рака, однако точные молекулярные механизмы, лежащие в основе их терапевтического действия, оставались неясными. Группа учёных под руководством Ральфа Юнгманна (профессор молекулярной физики жизни в LMU и руководитель исследовательской группы молекулярной визуализации и бионанотехнологий в Институте биохимии Макса Планка) впервые детально изучила, как терапевтические антитела изменяют организацию рецепторов на уровне отдельных молекул и как это влияет на их функцию.
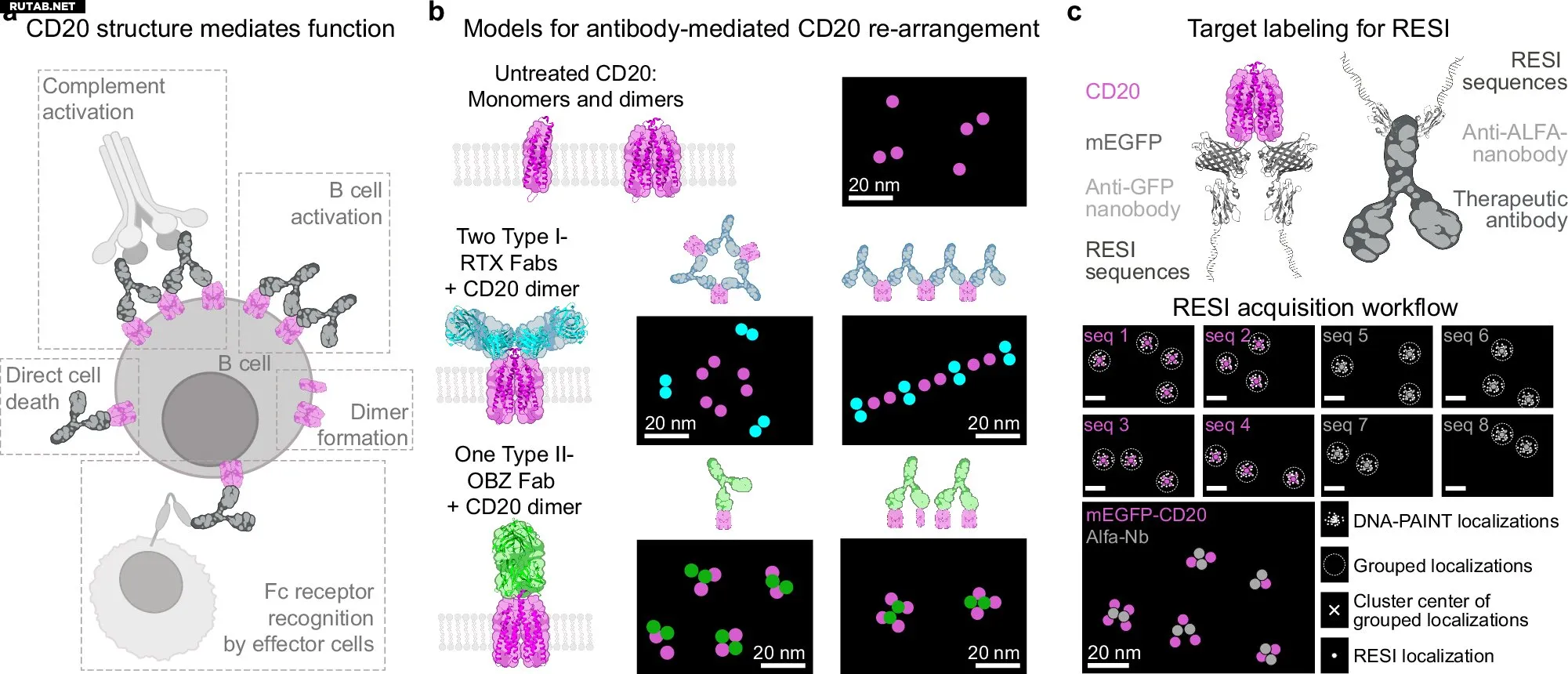
Используя метод Resolution Enhancement by Sequential Imaging (RESI) — новую технологию суперразрешающей микроскопии, позволяющую визуализировать отдельные белки, — исследователи напрямую наблюдали наноразмерную архитектуру рецепторов CD20 и их взаимодействие с широко применяемыми антителами, такими как Ритуксимаб и Обинутузумаб.
«Впервые мы можем визуализировать в интактных клетках, как комплексы антител с рецепторами организуются на уровне отдельных белков», — объясняет Юнгманн, ведущий автор исследования, опубликованного в журнале Nature Communications. «Эти наноразмерные паттерны напрямую коррелируют с терапевтической функцией и служат основой для рационального дизайна антител».
Визуализация комплексов антител с рецепторами с разрешением на уровне отдельных белков
Терапевтические моноклональные антитела действуют через несколько механизмов — активируют иммунные клетки, запускают комплемент-зависимые пути или напрямую индуцируют гибель клеток. Эти эффекты зависят от того, как антитела связываются и реорганизуют рецепторы на поверхности клетки. Однако традиционные методы визуализации не обладали достаточным разрешением, чтобы раскрыть эти процессы в естественной клеточной среде.
Команда Юнгманна преодолела это ограничение, применив метод 3D RESI, который маркирует рецепторы и антитела ортогональными ДНК-штрихкодами и последовательно визуализирует их с субнанометровой точностью. Это позволило исследователям детально изучить организацию рецепторов CD20 и связанных с ними антител непосредственно на клеточной мембране.
«Теперь мы можем напрямую увидеть, как структурные изменения в дизайне антител приводят к различным паттернам рецепторов и клеточным ответам», — говорит Изабель Пахмайр, первый автор исследования. «Это открывает путь для структурированного создания антител следующего поколения».
Новая эра в исследовании антител
Помимо CD20, технология RESI позволяет изучать практически любые мембранные рецепторы и терапевтические антитела с молекулярным разрешением непосредственно в интактных клетках. Поскольку RESI визуализирует целые клетки с высокой пропускной способностью, она позволяет систематически анализировать кандидатные антитела с разрешением, ранее доступным только с помощью криоэлектронной микроскопии, но теперь — непосредственно в клеточной среде и с уникальной молекулярной специфичностью.
В перспективе команда планирует комбинировать RESI с визуализацией множественных рецепторов и внутриклеточных сигнальных молекул, чтобы картировать целые терапевтические пути. «Впервые RESI объединяет структуру наноразмерных рецепторов с их функцией в клеточном контексте», — подводит итог Юнгманн. «Эта технология имеет потенциал фундаментально изменить иммунотерапию».
Дополнительная информация: Isabelle Pachmayr et al, Resolving the structural basis of therapeutic antibody function in cancer immunotherapy with RESI, Nature Communications (2025). DOI: 10.1038/s41467-025-61893-w






0 комментариев