Простой пептид может имитировать природный механизм защиты белков
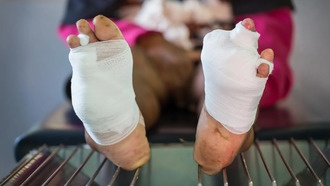
Изображение, полученное с помощью электронного микроскопа, демонстрирует смесь пористых сфер и полусферических частиц, образованных при испарении раствора пептидов. Автор: Шэн Чжан, доктор наук.
Новое исследование учёных из Центра передовых научных исследований при аспирантуре CUNY (CUNY ASRC) показало, что чрезвычайно простые пептиды могут имитировать биологический процесс, защищающий чувствительные белки от воздействия окружающей среды.
Результаты, опубликованные в журнале Nature Materials, предлагают новый перспективный подход к стабилизации биомолекул, таких как вакцины и терапевтические белки, — возможно, даже без необходимости охлаждения.
Исследование, проведённое под руководством Рейна Улийна, основателя инициативы CUNY ASRC в области нанонауки и профессора химии в Хантер-колледже, демонстрирует, как короткие пептиды — всего из трёх аминокислот — могут подвергаться разделению жидкость-жидкость в процессе высыхания, что позволяет им инкапсулировать белки, защищать их и высвобождать в неизменном виде при регидратации.
«Вдохновившись тем, как организмы, такие как тихоходки, выживают при экстремальном обезвоживании, мы задались вопросом: можем ли мы воспроизвести природную стратегию, используя минимальные синтетические материалы?» — сказал Улийн. «К нашему удивлению, мы обнаружили, что простые трипептиды могут образовывать динамичные, обратимые структуры, защищающие белки в стрессовых условиях. Это открывает новые возможности для сохранения белков».
В биологии клетки часто реагируют на стресс, создавая защитные компартменты с помощью процесса, известного как разделение фаз. Эти компартменты стабилизируют уязвимые белки и могут растворяться снова при улучшении условий.
Исследовательская группа применила этот принцип для разработки адаптируемых пептидных материалов, имитирующих данный процесс, — предлагая простую и эффективную альтернативу традиционным методам стабилизации биомолекул, которые часто требуют сложных формул и холодовой цепи.
Ключевые выводы исследования:
- Трипептиды могут образовывать обратимые, неупорядоченные структуры, подвергающиеся разделению фаз при высыхании.
- Эти структуры затвердевают в пористые микрочастицы, эффективно инкапсулируя белки.
- При регидратации пептиды высвобождают белки с сохранённой структурной целостностью.
- Процесс имитирует естественные защитные механизмы и даёт представление о новом способе образования супрамолекулярных материалов.
«Эта работа не только раскрывает новый механизм самоорганизации пептидов, но и представляет минималистичную платформу для биотехнологических применений», — отметил Улийн.
Последствия исследования значительны. От распространения вакцин в регионах без надёжного охлаждения до создания новых классов умных, адаптивных материалов — работа закладывает основу как для практических инноваций, так и для дальнейших научных изысканий.
Дополнительная информация: Adaptive peptide dispersions enable drying-induced biomolecule encapsulation, Nature Materials (2025). DOI: 10.1038/s41563-025-02300-z
Источник: CUNY Advanced Science Research Center









0 комментариев