Маленький белок с большим влиянием: как бактерии стабилизируют ключевой комплекс внешней мембраны
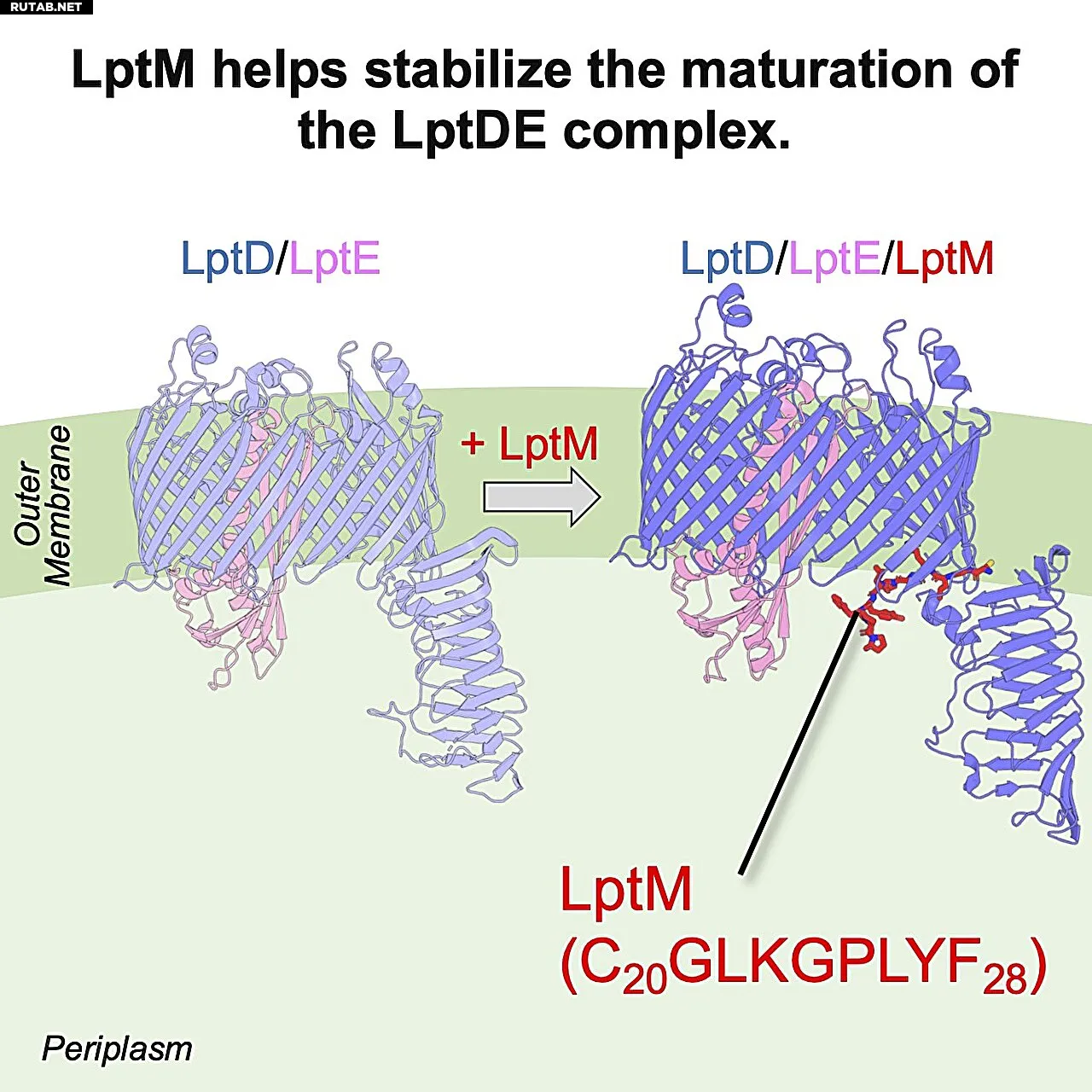
LptM напрямую взаимодействует с комплексом LptDE и стабилизирует его структуру во время сборки внешней мембраны. Автор: Рёдзи Миядзаки / Научно-технологический институт Нары, Япония
Грамотрицательные бактерии представляют серьёзную угрозу для глобального здравоохранения из-за их высокой устойчивости к антибиотикам по сравнению с грамположительными бактериями. Их мощные защитные способности обусловлены внешней мембраной (OM), которая действует как избирательный барьер против вредных соединений.
Внешняя мембрана — это не просто статичный щит, а динамичная структура, критически важная для выживания и вирулентности бактерий. Поэтому понимание того, как OM строится и поддерживается, имеет ключевое значение в борьбе с устойчивыми к лекарствам инфекциями.
Для создания такого эффективного защитного слоя бактерии полагаются на специализированные молекулярные механизмы. Система транспорта липополисахаридов (Lpt) играет ключевую роль в этом процессе, интегрируя функциональные комплексы липополисахаридов во внешнюю мембрану. Хотя некоторые компоненты этого транспортного пути, такие как комплекс LptDE, известны как жизненно важные для выживания бактерий, точные механизмы, управляющие их сборкой и созреванием, оставались неясными.
Исследовательская группа под руководством доцента Рёдзи Миядзаки из Научно-технологического института Нары (NAIST), Япония, сделала важное открытие, приближающее нас к пониманию этих процессов.
Их исследование, опубликованное в журнале Cell Reports, раскрывает критическую роль небольшого белка LptM в созревании и стабилизации LptD, который вместе с LptE формирует комплекс LptDE. В исследовании также участвовали Май Кимото, доктор Хидэтака Кога и профессор Томоя Цуказаки из NAIST.
Команда использовала комбинацию передовых методов, чтобы пролить свет на функцию LptM. Они исследовали точное время различных событий во время созревания LptD, продемонстрировав, что LptM действует на более поздней стадии, влияя на уже свёрнутые промежуточные формы LptD.
С помощью всестороннего мутационного анализа они идентифицировали короткий участок LptM, состоящий менее чем из десяти аминокислотных остатков, как критически важный для его функции. Затем исследователи использовали криоэлектронную микроскопию, чтобы получить высокоразрешающую структуру комплекса LptDEM у кишечной палочки (Escherichia coli).
Этот анализ в сочетании с биохимическими экспериментами предоставил беспрецедентное молекулярное представление о том, как LptM напрямую взаимодействует со комплексом LptDE и стабилизирует его.
Результаты показали, что LptM располагается на критическом интерфейсе внутри LptD, что предполагает его роль в тонкой настройке структуры этого белка для Lpt. Это углублённое понимание процесса сборки LptDE имеет значительные последствия для будущих терапевтических достижений.
«Наше исследование подчёркивает ключевую роль LptM, предоставляя фундаментальные знания, которые могут поддержать разработку антибиотиков, поскольку комплекс LptDE был идентифицирован как потенциальная мишень для новых антибиотиков», — заявляет доктор Миядзаки.
Помимо потенциальных мишеней для лекарств, это исследование также проливает свет на более широкий биологический принцип.
«Наши результаты показывают, что маленькие белки, многие из которых ранее игнорировались, могут играть критическую роль в сборке и регуляции более крупных мембранных белковых комплексов. Это открывает новую перспективу в фундаментальной биологии, подчёркивая функциональную значимость малых белков», — отмечает доктор Миядзаки.
Действительно, такие результаты могут открыть новые пути для изучения ранее нераспознанных функций этих «микробелков» в различных клеточных процессах.
Дополнительная информация: Рёдзи Миядзаки и др., Structural basis of lipopolysaccharide translocon assembly mediated by the small lipoprotein LptM, Cell Reports (2025). DOI: 10.1016/j.celrep.2025.116013
Источник: Nara Institute of Science and Technology











0 комментариев