Разработан инновационный метод суперразрешения для безопасного наблюдения за живыми клетками
Траектория движения одного из облакоподобных фокусов 53BP1 в течение нескольких секунд; быстрое восстановление зеленого сигнала после фотообесцвечивания указывает на быстрый обмен белком. Автор: Queen Mary, University of London
Учёные из Центра клеточной динамики Лондонского университета королевы Марии в сотрудничестве с Carl Zeiss разработали инновационную методику визуализации живых клеток, которая сочетает разрешение 60 нанометров с технологией флуоресцентного восстановления после фотообесцвечивания (FRAP), значительно снижая при этом повреждение клеток светом. Этот прорыв позволяет исследователям наблюдать сложные клеточные процессы с беспрецедентной детализацией, открывая новые возможности для изучения фундаментальных биологических механизмов, включая репарацию ДНК и динамику хромосом.
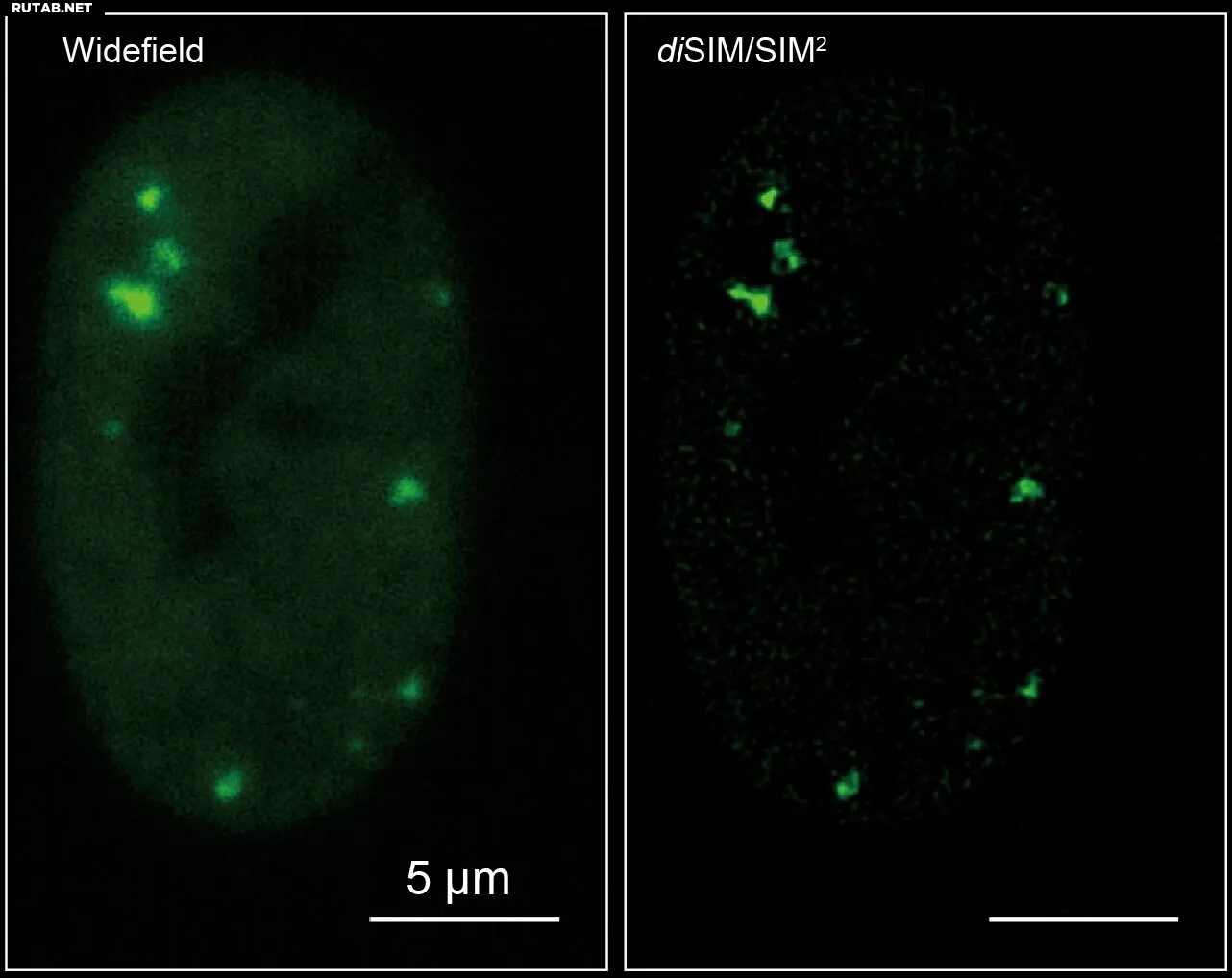
Команда под руководством профессора Виджи Дравиам успешно объединила решётчатую структурированную микроскопию (diSIM/SIM²) с FRAP, создав новый метод под названием FRAP-SR. Эта технология преодолевает ограничения традиционной микроскопии и более ранних методов суперразрешения, которые часто страдают от фототоксичности, мешающей изучению деликатных биологических процессов в живых клетках. Результаты исследования опубликованы на сервере препринтов bioRxiv.
"Наш метод FRAP-SR позволяет визуализировать структуры размером всего 60 нанометров в живых клетках — масштаб, ранее недоступный для динамических исследований без значительного стресса для клеток", — объясняет профессор Дравиам. "Это разрешение, в 2000 раз меньшее ширины человеческого волоса, позволяет изучать наноразмерную организацию и поведение клеточных компонентов в реальном времени."
Используя FRAP-SR, исследователи изучили динамику белка 53BP1, играющего ключевую роль в репарации двуцепочечных разрывов ДНК. Высокодетализированная визуализация показала, что 53BP1 образует жидкообразные конденсаты удивительной сложности. Некоторые из этих фокусов выглядели как стабильные компактные структуры, тогда как другие демонстрировали более текучие, динамичные формы.
Ядра клеток с участками повреждения ДНК, отмеченными зелёными облакоподобными фокусами 53BP1. Автор: Queen Mary, University of London
Применяя FRAP-SR, команда обнаружила, что аморфные фокусы 53BP1 содержат отдельные субкомпартменты с разной подвижностью белков, что указывает на функциональную специализацию внутри этих репарационных центров. В отличие от них, компактные фокусы демонстрировали равномерное восстановление после фотообесцвечивания, но с большей вариабельностью скоростей восстановления между разными фокусами. Исследование также показало, что динамика этих фокусов зависит от клеточных условий, таких как восстановление после репликационного стресса ДНК.
"FRAP-SR предоставляет мощный инструмент для анализа динамической архитектуры белковых комплексов на наноуровне в живых клетках", — подчёркивает профессор Дравиам. "Это позволяет нам исследовать фундаментальные клеточные процессы, особенно чувствительные к световому воздействию, с беспрецедентной детализацией и минимальным вмешательством. Это изменит область оптогенетики в режиме суперразрешения и ускорит разработку новых противораковых препаратов, нацеленных на динамические пути репарации ДНК."
Это достижение открывает большие перспективы для исследователей в области клеточной биологии, изучающих широкий спектр светочувствительных процессов, включая ответ на повреждение ДНК, организацию хромосом, динамику митохондрий и клеточное старение. Возможность изучать эти процессы с высоким разрешением в живых клетках без повреждений несомненно ускорит открытия в этих областях.
Глобальный рынок препаратов для репарации ДНК оценивался примерно в 9,18 млрд долларов (734 млрд рублей) в 2024 году и, по прогнозам, достигнет 13,97 млрд долларов (1,12 трлн рублей) к 2030 году при среднегодовом темпе роста около 7,2%. Команда продемонстрировала, как маркер повреждения ДНК 53BP1 можно использовать в живых клетках с помощью FRAP-SR для ускорения разработки новых препаратов или кандидатов в препараты для репарации ДНК, актуальных для персонализированной медицины.
Система ZEISS Elyra 7, усовершенствованная возможностями FRAP от Rapp OptoElectronics, сыграла ключевую роль в этом исследовании, обеспечив необходимое суперразрешение для впервые выявленных субкомпартментов фокусов 53BP1. Сотрудничество профессора Дравиам с Zeiss и Rapp OptoElectronics по интеграции FRAP и структурированной микроскопии позволило точно количественно оценить динамику белков.
Дополнительная информация: Chengchen Wu et al, FRAP-in-SR: Fluorescence recovery in the Super-Resolution regime reveals subcompartments of 53BP1 foci, bioRxiv (2025). DOI: 10.1101/2025.05.07.652606
Источник: Queen Mary, University of London







0 комментариев