Созданы искусственные синаптические везикулы, управляемые светом
Ученые из Института нанобиологических наук (WPI-NanoLSI) Университета Канадзавы создали искусственные синаптические везикулы, которыми можно дистанционно управлять с помощью ближнего инфракрасного (БИК) света. Встраивание фталоцианинового красителя в липидные мембраны позволяет вызывать локальный нагрев, который регулирует проницаемость мембраны для точного высвобождения нейромедиаторов, например, ацетилхолина.
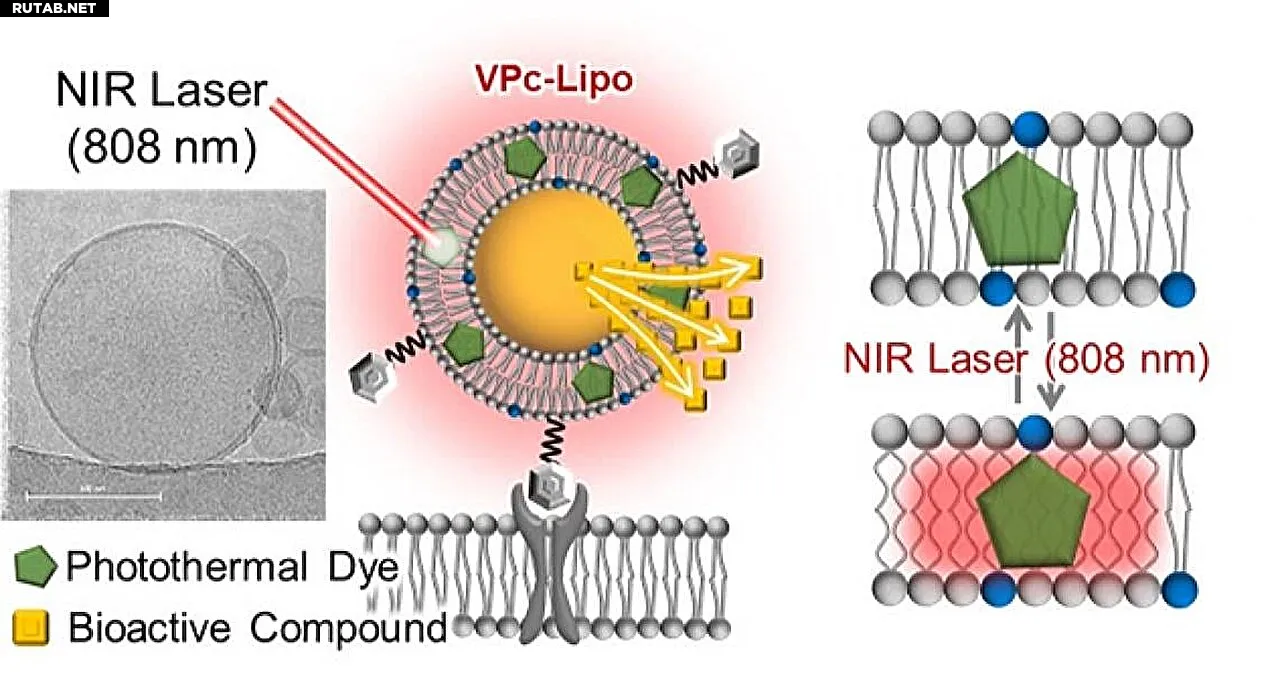
Рис. 1. Липосома, способная к высвобождению биоактивных соединений по требованию при облучении ближним инфракрасным (БИК) лазером. Фототермический краситель (VPc) встроен в липидную мембрану, и облучение БИК-светом вызывает локальный нагрев, который ослабляет мембрану и позволяет контролировать высвобождение. Автор: ACS Nano (2025). DOI: 10.1021/acsnano.5c08482
Исследование, опубликованное в журнале ACS Nano, показывает, что наномасштабный нагрев может контролировать коммуникацию между нервными клетками. Работа открывает новые пути для негенетической модуляции нейронной активности с потенциальным применением в нейробиологии, доставке лекарств и биоинженерии.
Команда под руководством Сатоси Араи продемонстрировала, что встраивание красителя ванадиевого фталоцианина (VPc) в мембраны липосом позволяет вызывать светом локальный нагрев, ограниченный молекулярным уровнем. В отличие от обычных термочувствительных липосом, которым требуется общий нагрев, этот подход обеспечивает обратимое и высоколокализованное высвобождение молекул-«груза» без причинения широкого теплового повреждения.
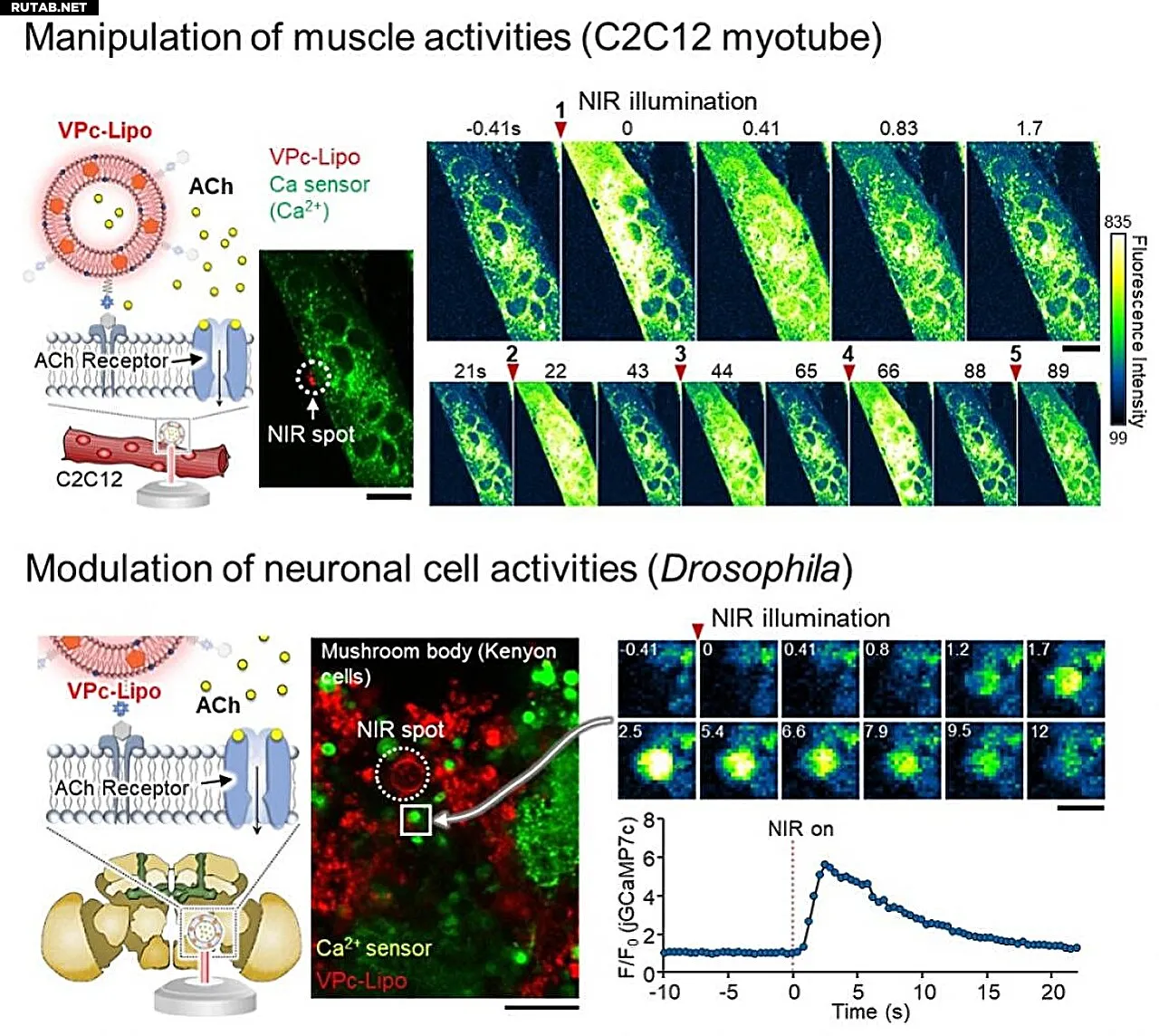
Рис. 2. Применение в качестве искусственной синаптической везикулы. (Верхняя панель) Схематическая иллюстрация высвобождения ацетилхолина (ACh) в направлении дифференцированных мышечных клеток и оценки активации ацетилхолиновых рецепторов с помощью кальциевой визуализации. (Нижняя панель) Схематическая иллюстрация высвобождения ACh в направлении мозга дрозофилы (ex vivo) и наблюдения нейронной активности с помощью кальциевой визуализации. Автор: ACS Nano (2025). DOI: 10.1021/acsnano.5c08482
Ключевые результаты
В лабораторных экспериментах исследователи инкапсулировали ацетилхолин в липосомы с VPc и показали, что импульсы БИК-света могут запускать быстрое высвобождение нейромедиатора в заданных местах. Этого высвобождения было достаточно, чтобы вызвать кальциевый поток в мышечных клетках и нейронные ответы в мозге дрозофилы. Молекулярно-динамическое моделирование подтвердило, что VPc предпочтительно локализуется внутри липидных мембран, обеспечивая эффективное тепловое ограничение.
«Ограничивая нагрев липидным бислоем, мы достигли точного контроля высвобождения нейромедиатора в термически чувствительных биологических системах, — пишут авторы. — Эта светомодулируемая везикулярная система представляет собой многообещающую платформу для изучения нейронной коммуникации».
Потенциальное влияние
Исследование представляет новую концепцию искусственных синаптических везикул, модулируемых БИК-светом. Этот подход может быть расширен для создания целевых систем доставки лекарств, биопротезов и микроинструментов для нейробиологии, а также повлиять на разработку технологий в регенеративной медицине и биоинспирированных наноустройствах.








0 комментариев