Ученые выяснили, как клетки «тянут за аварийный тормоз» при нехватке кислорода
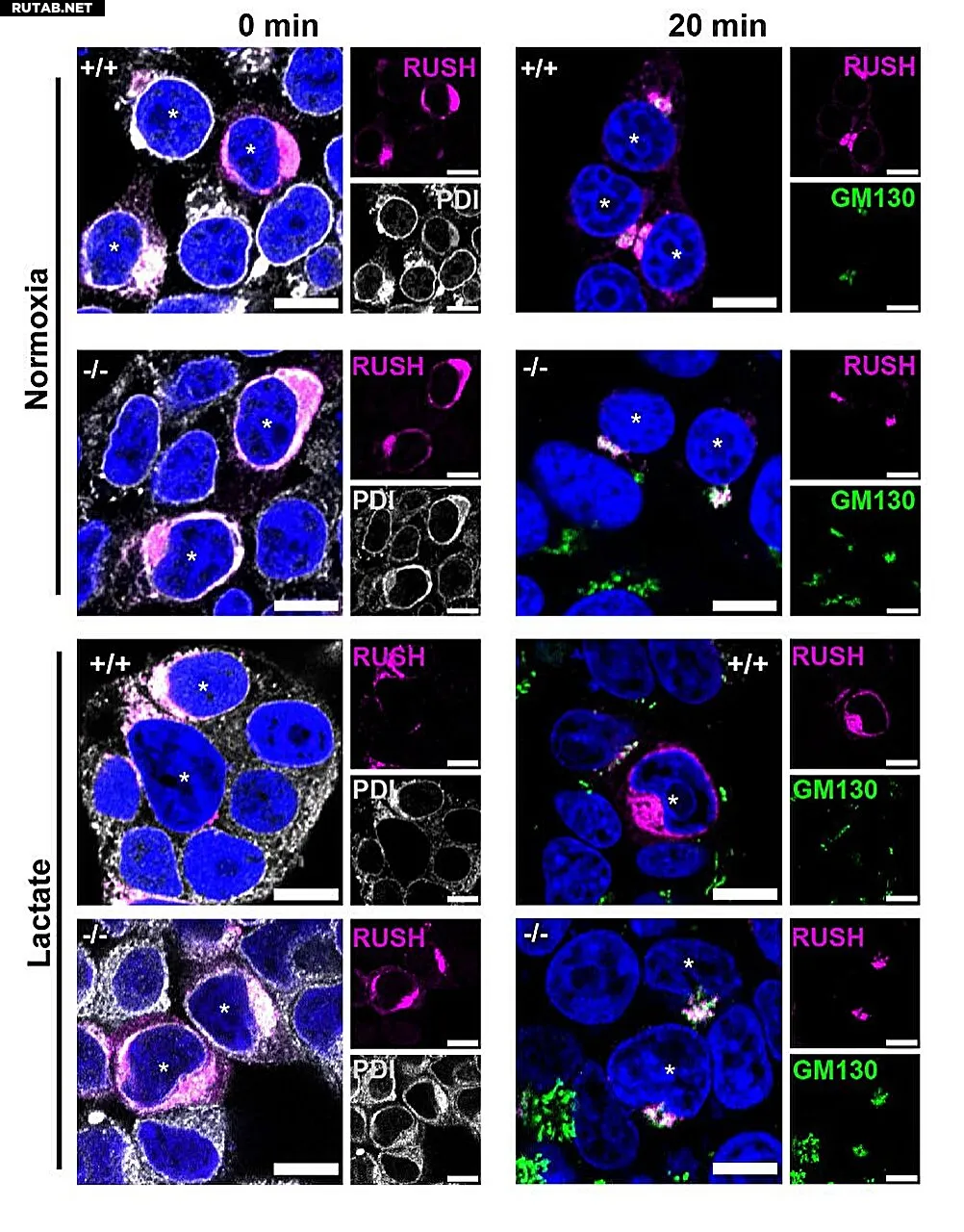
RUSH-анализ в условиях нормоксии (верхние две панели) и в присутствии лактата (нижние две панели) для клеток HEK293 дикого типа и NDRG3-/-. Автор: Proceedings of the National Academy of Sciences (2025). DOI: 10.1073/pnas.2511307122
Когда человеческим клеткам не хватает кислорода, они должны отреагировать. Без кислорода метаболизм с трудом вырабатывает энергию, и многие жизненно важные процессы начинают давать сбои. Исследовательская группа из Билефельдского университета вместе с международными партнерами обнаружила, как клетки могут экономить энергию в такой ситуации: они намеренно замедляют так называемый секреторный путь — транспортный маршрут, через который клетки выделяют такие вещества, как белки, наружу или перенаправляют их в другие клеточные компартменты.
Исследование было опубликовано в журнале PNAS.
Исследователи показывают, что белок NDRG3 играет центральную роль в этой адаптации. NDRG3 действует как сенсор для продукта метаболизма — лактата, который накапливается при недостатке кислорода (гипоксии).
Белок вмешивается в транспортный процесс между двумя органеллами: эндоплазматическим ретикулумом (ЭПР) и аппаратом Гольджи. Эти структуры функционируют как производственный и отгрузочный отделы клетки: белки производятся в ЭПР и далее обрабатываются и распределяются в аппарате Гольджи.
«Мы смогли показать, что NDRG3 специфически замедляет транспорт между ЭПР и Гольджи в периоды нехватки кислорода», — объясняет профессор Михаэль Шваке, последний автор исследования. «Это позволяет клетке экономить энергию и избегать ненужной активности в то время, когда она работает в режиме пониженного энергопотребления».
Профессор (Apl.) д-р Михаэль Шваке и Пиа Ферле в лаборатории Билефельдского университета. Автор: Майк-Деннис Мюллер
Молекулярный переключатель, который экономит энергию
В деталях исследователи обнаружили, что NDRG3 связывается с лактатом — побочным продуктом метаболизма, который накапливается при недостатке кислорода, и, будучи «загруженным» лактатом, может взаимодействовать с определенной формой синтаксина-5.
Этот белок является частью так называемого SNARE-комплекса, молекулярной системы слияния мембран, которая перемещает маленькие везикулы, содержащие транспортные материалы, из одной области клетки в другую. Связываясь с синтаксином-5, NDRG3 намеренно нарушает этот процесс и обеспечивает замедление транспорта между ЭПР и Гольджи.
Если NDRG3 отсутствует, этот тормозной механизм не срабатывает: клетки, лишенные белка, продолжают транспорт даже при дефиците кислорода. Эти находки, таким образом, предоставляют новое механистическое звено между недостатком кислорода и регуляцией клеточного метаболизма.
Новые взгляды на механизмы заболеваний
Понимание этих процессов актуально не только для клеточной биологии. «Некоторые заболевания, такие как мышечные расстройства и эпилепсии, связаны с нарушениями именно этих транспортных путей», — говорит Пиа Ферле.
«Наши выводы могут, таким образом, в долгосрочной перспективе помочь объяснить, почему такие заболевания возникают на молекулярном уровне и как их можно лечить более эффективно».
Исследование объединяет две ранее раздельные области исследований: клеточный ответ на недостаток кислорода и результирующее увеличение лактата, и регуляцию белкового транспорта внутри клетки. Оно демонстрирует, насколько тесно взаимосвязаны эти процессы и насколько точно клетки могут реагировать на изменяющиеся условия окружающей среды.
Помимо команды профессора Шваке, в исследовании также участвовали ученые из США. Команда Билефельдского университета возглавила проект и детально проанализировала молекулярные механизмы.
Больше информации: Пиа Э. Ферле и др., The lactate sensor NDRG3 decelerates ER-to-Golgi transport through interaction with the long isoform of syntaxin-5, Proceedings of the National Academy of Sciences (2025). DOI: 10.1073/pnas.2511307122
Источник: Bielefeld University











0 комментариев