Ученые выяснили, как бактерии Acinetobacter baumannii развивают устойчивость к антибиотикам
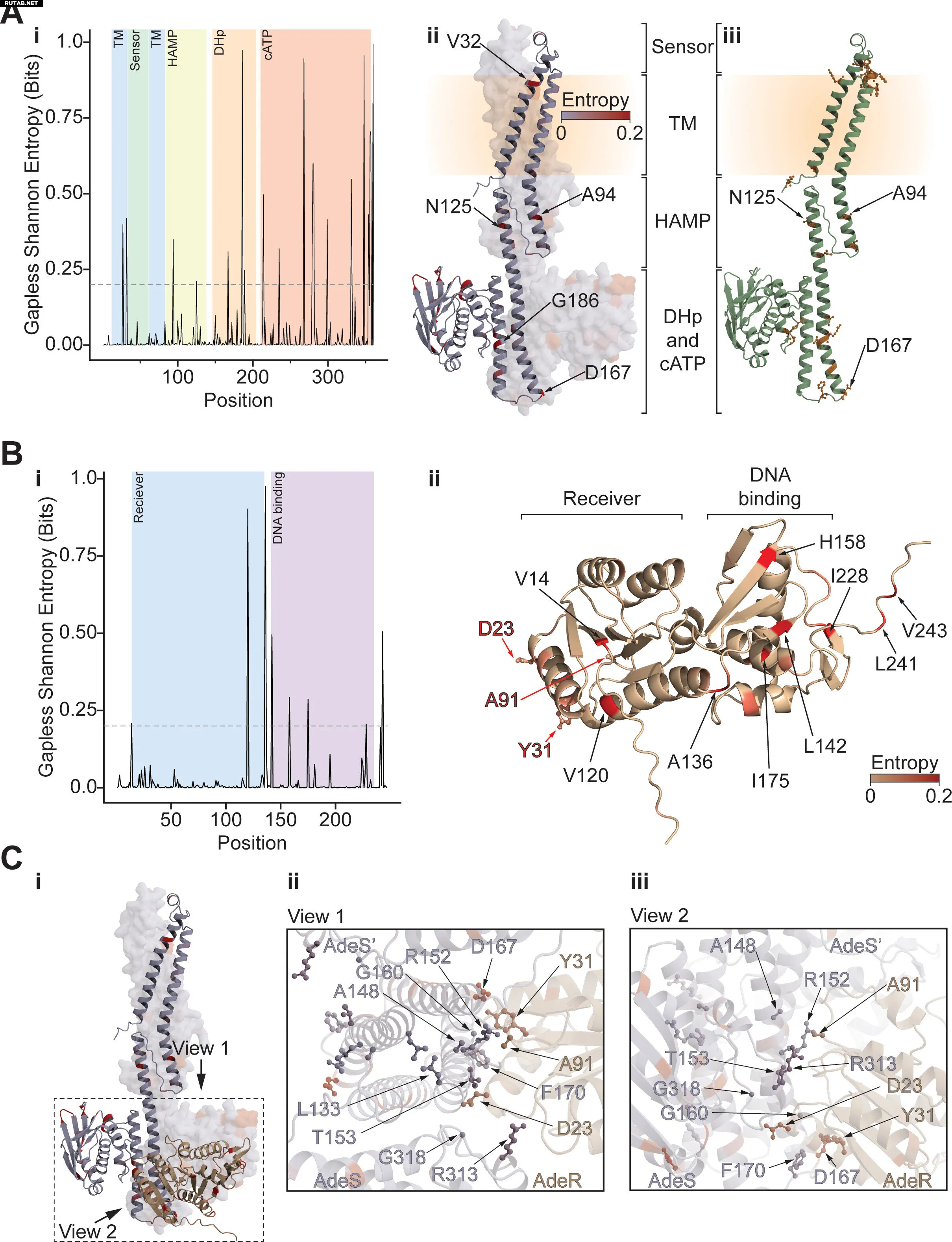
Анализ позиционной энтропии AdeSR и распределения вариантов в морбидостате. Автор: Antimicrobial Agents and Chemotherapy (2025). DOI: 10.1128/aac.00809-25
Бактерия Acinetobacter baumannii представляет серьезную угрозу в американских больницах, где более 1% пациентов лечатся от вызванных ею инфекций. Этот вид известен динамичным геномом и способностью развивать устойчивость к антибиотикам.
«Это смертоносный патоген, печально известный своей устойчивостью к традиционным препаратам», — заявил профессор Андрей Остерман из Центра науки о данных и искусственного интеллекта Института медицинских открытий Сэнфорда Бернема Пребиса.
Ученые из Сэнфорда Бернема Пребиса и их коллеги из Roche Pharmaceuticals 29 октября 2025 года опубликовали в журнале Antimicrobial Agents and Chemotherapy результаты исследования, в котором использовали экспериментальный эволюционный подход для картирования генетических мутаций у A. baumannii, обработанной двумя редко применяемыми антибиотиками.
«Тигециклин и колистин — это последняя линия защиты врачей от инфекций A. baumannii, — пояснил Остерман. — Их редко используют в США, и существующая устойчивость пока сравнительно низка, но растет, что побудило нас изучить, как бактерии приобретают новую резистентность».
Исследователи проводили эксперименты с помощью морбидостата — устройства, которое позволяет бактериям непрерывно расти в течение многих поколений, находясь под постепенно возрастающим давлением выживания из-за воздействия антибиотиков. Компьютер контролирует рост культуры и увеличивает дозу препарата, пока культура быстро размножается.
«Это работает как эволюционная машина, которая точнее имитирует условия в человеческом организме по сравнению с другими методами, — сказал Остерман. — В сочетании с геномным секвенированием этот подход позволяет создать максимально полную карту всех теоретически возможных мутаций, обеспечивающих устойчивость к препаратам».
Картирование подтвердило и расширило существующие знания об основных механизмах резистентности. Первичный источник устойчивости к тигециклину связан с мутациями, влияющими на то, как бактерии изолируют и выводят препараты до того, как они повредят клетки. Эти системы называются эффлюксными насосами.
Второй важный аспект устойчивости был связан с эволюцией резистентности к колистину. Команда идентифицировала мутации, влияющие на активность фермента, который может предотвращать достижение колистином своей цели — компонента бактериальной клеточной стенки.
«Имея полную карту возможных мутаций, мы можем сравнивать ее с другими секвенированными геномами, включая образцы от пациентов с инфекциями A. baumannii», — отметил Остерман.
В сравнительный анализ вошли более 10 000 публично доступных геномов различных изолятов A. baumannii.
Исследователи рассматривают эту работу как шаг к созданию прогностических моделей лекарственной устойчивости на основе геномики, которые можно будет использовать в клиниках.
«Серьезная проблема возникает, когда пациентов лечат методом проб и ошибок, назначая антибиотик, к которому бактерии уже устойчивы, — пояснил Остерман. — Это дополнительно стимулирует резистентность, и вы теряете время, которого у пациентов не всегда много».
«Накопленные данные позволят врачам назначать секвенирование и прописывать антибиотик, к которому бактерии с наименьшей вероятностью устойчивы. Это поможет как отдельным пациентам, так и в глобальном масштабе замедлить эволюцию антибиотикорезистентности».
Больше информации: J. E. Kent et al, Mutations in two-component signaling systems drive experimental evolution of tigecycline and colistin resistance in Acinetobacter baumannii, Antimicrobial Agents and Chemotherapy (2025). DOI: 10.1128/aac.00809-25











0 комментариев