Ученые раскрыли механизм происхождения систем CRISPR-Cas типа V
Открытие систем TranC раскрывает молекулярный механизм происхождения CRISPR. Автор: IGDB
Системы CRISPR-Cas представляют собой адаптивные иммунные системы прокариот, которые защищают от вторжения нуклеиновых кислот посредством направляемого CRISPR РНК расщепления. Системы CRISPR-Cas типа V (Cas12), в частности, служат одним из самых мощных инструментов для редактирования генома, особенно в фундаментальных исследованиях, медицине и сельском хозяйстве.
Исследователи под руководством профессора Гао Цайся из Института генетики и биологии развития Китайской академии наук, совместно с доцентом Лю Цзюньцзе из Университета Цинхуа и профессором Чжан Юном из Института зоологии КАН, теперь раскрыли молекулярное новшество, которое привело к происхождению иммунных систем CRISPR-Cas типа V.
Их выводы, опубликованные 29 сентября в журнале Cell, показывают, что функциональное разделение РНК, производных от транспозонов, стало ключевым новшеством, обусловившим появление иммунитета CRISPR-Cas типа V.
Предыдущие исследования показали, что белки-предшественники эффекторов Cas12 типа V — это нуклеазы TnpB, кодируемые транспозонами IS200/605. Однако молекулярные механизмы, связывающие активность транспозона и CRISPR-иммунитет, оставались неясными.
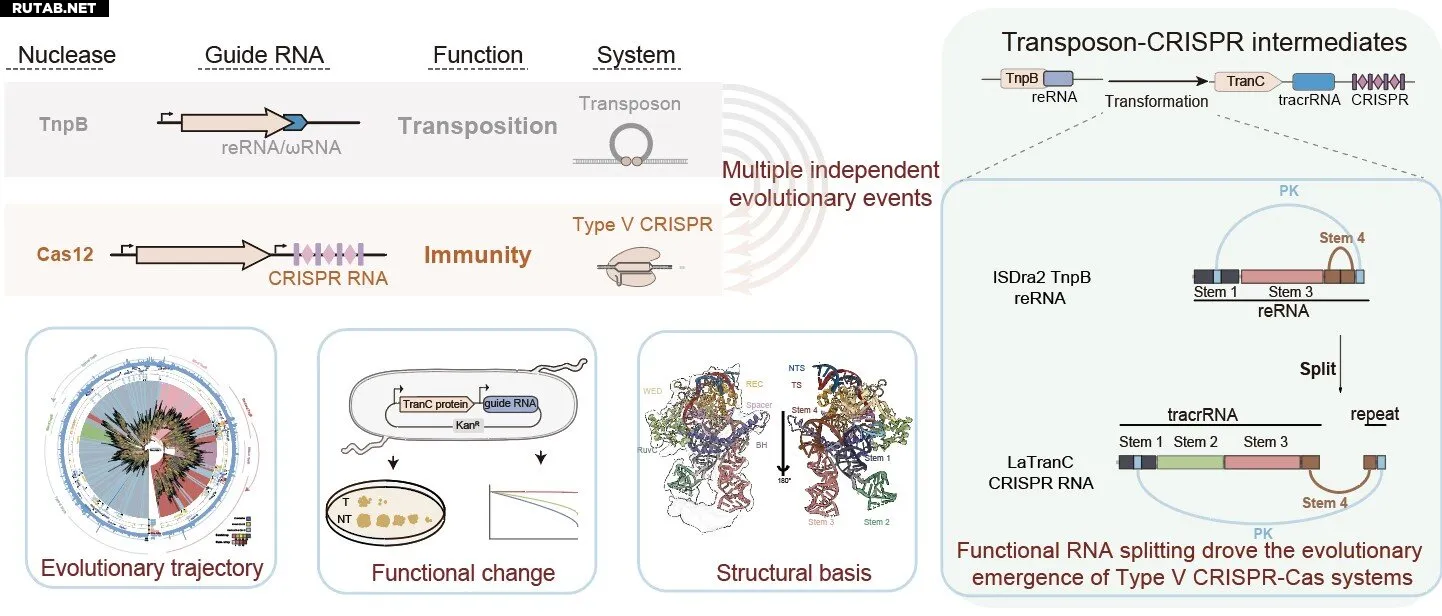
Чтобы выяснить происхождение систем CRISPR-Cas типа V, исследователи разработали унифицированную стратегию поиска, которая объединила каталитические мотивы, структурные домены и сходство последовательностей, общие для нуклеаз TnpB и Cas12.
Проанализировав геномы прокариот и метагеномные базы данных, они идентифицировали 146 CRISPR-ассоциированных белков, подобных TnpB. С помощью филогенетического анализа, структурных предсказаний на основе AlphaFold и сравнения функциональных элементов исследователи в конечном итоге идентифицировали шесть промежуточных клад, коллективно названных TranCs, которые образуют сестринские группы для определенных линий TnpB. Примечательно, что клады 3, 11, 12, 13 и 14 происходят от IS605, тогда как ранее сообщавшаяся клада 8 (Cas12n) возникает из IS607, представляя ключевые эволюционные промежуточные звенья между TnpB и Cas12.
Функциональные анализы выявили уникальный для TranCs механизм двухкомпонентной направляющей РНК. Исследователи обнаружили, что пять систем TranC не только использовали свои собственные CRISPR РНК (гибриды tracrRNA-crRNA) для нацеливания на ДНК, но и сохранили способность предков использовать РНК, производные от транспозонов (reRNA, также называемые ωRNA), для направленного расщепления ДНК. Эта способность к двойному руководству является функциональной характеристикой, показывающей, что TranCs являются эволюционными промежуточными звеньями.
Крио-ЭМ анализ комплекса LaTranC-sgRNA-ДНК также выявил поразительное сходство с комплексом ISDra2 TnpB-reRNA-ДНК, с одним ключевым отличием: единая reRNA претерпела функциональное разделение на два компонента — tracrRNA и crRNA. Анализ ковариации reRNA и CRISPR РНК, а также сравнение белковых моделей AlphaFold распространили это наблюдение на три клады из IS605 и IS607, установив разделение РНК в качестве общей черты возникновения Cas12.
Что важно, инженерные эксперименты подтвердили, что искусственное разделение reRNA TnpB было достаточным для преобразования TnpB в CRISPR-подобную систему, способную использовать CRISPR-кассеты в качестве источника направляющих РНК. Эти результаты демонстрируют, что инновация на уровне РНК, а не крупные структурные изменения белка, стала первичным молекулярным событием, обусловившим происхождение систем CRISPR-Cas типа V.
Это исследование значимо не только для прояснения молекулярного механизма эволюции систем CRISPR типа V, но и для идентификации набора компактных нуклеаз с гибкими направляющими РНК, что предлагает принципы проектирования для разработки CRISPR-инструментов, которые меньше по размеру, более универсальны и легче поддаются контролю.
Больше информации: Functional RNA splitting drove the evolutionary emergence of Type V CRISPR-Cas systems from transposons, Cell (2025). DOI: 10.1016/j.cell.2025.09.004
Источник: Chinese Academy of Sciences





0 комментариев