Ученые впервые увидели, как белок калпротектин лишает бактерии цинка
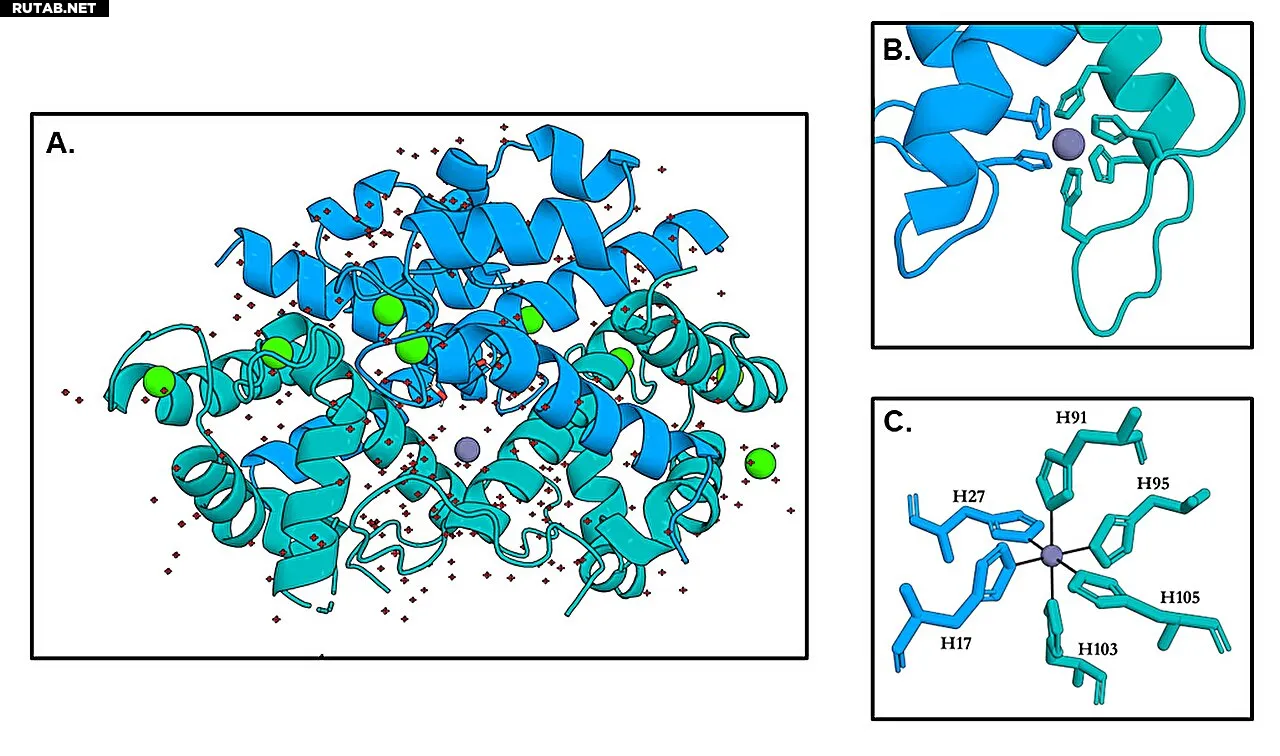
Кристаллическая структура калпротектина с связанным цинком в сайтах His₆. (A) Общая структура гетеротетрамера калпротектина. Ионы Zn²⁺ показаны серыми сферами, ионы Ca²⁺ — зелеными, молекулы воды — красными. (B) Крупный план иона Zn²⁺, связанного в сайте His₆, показывающий октаэдрическую координацию шестью гистидинами. (C) Расширенный вид сайта His₆, где Zn²⁺ полностью окружен шестью гистидинами из обоих субъединиц S100A8 (синий) и S100A9 (голубой). Автор: Рэнди Перера
Ученые впервые определили кристаллические структуры калпротектина — белка иммунной системы — со связанным цинком. Это открытие показывает, как наш организм лишает бактерии жизненно важного для них металла, что является ключевой стратегией врожденного иммунитета.
Исследование, опубликованное в журнале Protein Science, выявило, что в сайте His₆ цинк удерживается в октаэдрической «клетке», образованной шестью гистидиновыми остатками из двух субъединиц белка. В другом сайте связывания, His₃Asp, цинк имеет тетраэдрическую координацию. Эти структуры впервые наглядно демонстрируют механизм, который ранее лишь предполагался биохимиками.
Оказалось, что калпротектин удерживает цинк с чрезвычайно высоким сродством (пикомолярный диапазон), и эта способность сохраняется даже при удалении или замене гистидинов в гибком С-концевом хвосте белка S100A9. Хотя хвост и участвует в формировании координационной сферы, основная «захватывающая» функция от него не зависит.
Однако хвост играет другую важную биологическую роль. Эксперименты с Staphylococcus aureus показали, что изменения в хвосте влияют на то, как бактерии формируют биопленки и взаимодействуют с калпротектином, даже когда лишение цинка остается эффективным.
Таким образом, калпротектин действует на двух уровнях: химическом (жесткое связывание цинка) и взаимодействия (влияние на рост и организацию бактериальных сообществ через С-концевой хвост). Это открытие может помочь в разработке новых стратегий борьбы с устойчивыми бактериальными инфекциями, такими как биопленки S. aureus, которые осложняют лечение ран и инфекций, связанных с медицинскими устройствами.
Больше информации: Yasiru R. Perera et al, The C‐terminal extension of calprotectin mediates zinc chelation and modulates Staphylococcus aureus biomass accumulation, Protein Science (2025). DOI: 10.1002/pro.70294





0 комментариев