Учёные открыли новый механизм реакции CO₂ на поверхности воды
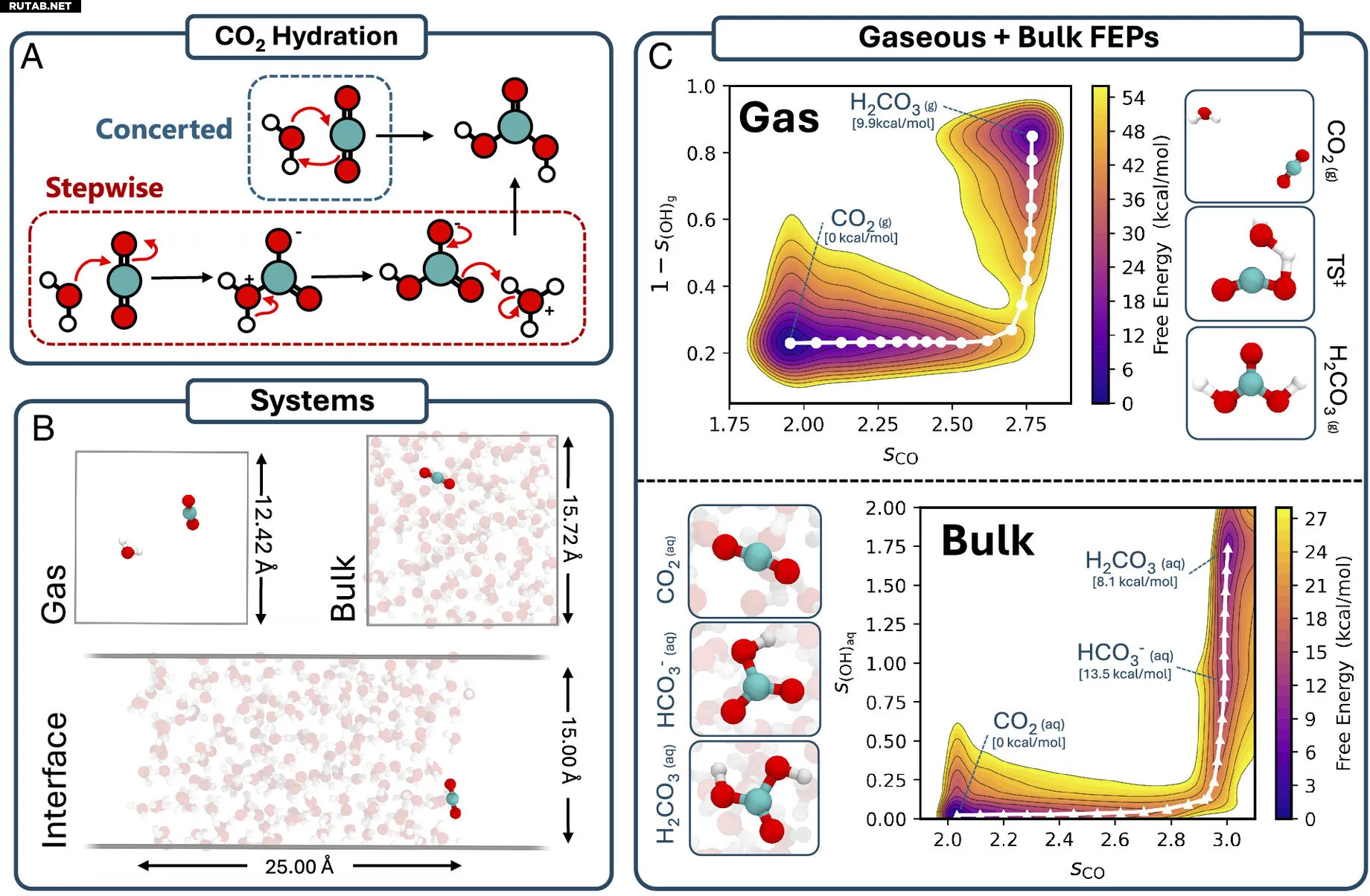
Моделирование реакции CO2 + H2O с помощью расширенных молекулярных симуляций. (A) Механизмы реакции CO2 + H2O с образованием угольной кислоты (H2CO3) через согласованный и ступенчатый пути. Согласованный путь показан для одной реагирующей молекулы воды, хотя дополнительные молекулы H2O могут участвовать в образовании цепи переноса протона. (B) Системные установки, используемые для исследования реакции CO2 + H2O в газообразной, объёмной и межфазной средах. (C) Профили свободной энергии, полученные из метадинамических симуляций для газообразных и объёмных реакций. Свободные энергии отображены как функция координационного числа C–O (sCO), а также специализированных коллективных переменных состояния протонирования для газообразной (s(OH)g) и водной (s(OH)aq) фаз. Репрезентативные снимки различных видов, обнаруженных во время симуляций, показаны рядом с профилями. Автор: Proceedings of the National Academy of Sciences (2025). DOI: 10.1073/pnas.2502684122
Каждый год в атмосферу выбрасываются миллиарды тонн CO2. Значительная часть этого газа попадает в океаны Земли, где он может реагировать с водой с образованием угольной кислоты, что вызывает закисление океана.
Хотя многие исследования были сосредоточены на том, как этот процесс происходит в глубине жидкости, меньше внимания уделялось тому, как эта реакция протекает на границах раздела фаз, где вода встречается с другим веществом, например, на поверхности океана.
В исследовании, опубликованном в PNAS, исследователи из Кембриджа и Университетского колледжа Лондона обнаружили, что CO₂ может реагировать в самом верхнем слое воды через новый механизм «внутрь и наружу». В этом процессе, вместо того чтобы полностью растворяться в воде, CO₂ ненадолго погружается в поверхностный слой, реагирует, а затем снова появляется. Это происходит в очень тонком слое, толщиной всего в несколько молекул.
«Это похоже на то, что вместо того, чтобы глубоко нырять в воду для реакции, CO₂ делает бысткое погружение в воду, частично растворяясь в самом верхнем слое воды, где он может реагировать с образованием угольной кислоты. Затем этот кислотный вид возвращается на поверхность и выходит обратно», — объяснил Сэмюэл Брукс, первый автор статьи и аспирант кафедры химии Юсуфа Хамида и Кавендишской лаборатории в Кембридже.
Механизм «внутрь и наружу» бросает вызов предыдущим предположениям о том, где и как CO₂ превращается в угольную кислоту, и показывает, что реакции могут происходить прямо на поверхности воды, а не только глубоко внутри нее.
Понимание того, как CO₂ реагирует на поверхности воды, имеет решающее значение для улучшения климатических моделей и прогнозов.
Ученые из предыдущих исследований знают, что большое количество CO₂ скапливается на поверхности океана. Теперь команда из Кембриджа предполагает, что этому поверхностному CO₂ не нужно полностью растворяться перед реакцией. Вместо этого он может реагировать прямо там, где находится, что означает, что закисление океана может происходить быстрее, чем считалось ранее.
«К сожалению, это говорит о том, что текущие прогнозы об изменениях pH океана, который измеряет его кислотность, могут быть недооценены», — сказал Брукс. — Это делает необходимость в точных климатических моделях еще более urgent».
Ученые использовали машинное обучение для изучения этого процесса закисления на границе раздела воздух-вода. Модели, обученные на точных квантовых данных, позволили им смоделировать реакцию на уровне атомов и молекул. Из этих наблюдений на молекулярном уровне исследователи смогли сделать значимые прогнозы, такие как энергии и пути реакции.
Исследователи были удивлены сходством между реакцией на границе раздела и в объемном растворе. Они ожидали, что реакция образования угольной кислоты будет намного сложнее на поверхности воды, чем глубже в воде, из-за меньшего количества доступных молекул воды, что может затруднить химические реакции.
«Но из-за этого механизма "внутрь и наружу" мы обнаружили, что отсутствие окружающих молекул воды на поверхности не усложнило реакцию, как мы изначально предсказывали, и энергия, необходимая для образования угольной кислоты, была примерно такой же на поверхности, как и глубже в воде», — пояснил Брукс.
Обнаружив основной механизм реакции, команда также была очарована тем, насколько сильно изменились свойства реакции на таком коротком расстоянии.
«Переместив CO₂ всего на долю нанометра — перейдя из положения над водой в самый верхний слой — мы практически вдвое сократили барьер для реакции», — сказал доктор Кристоф Шран, руководитель группы FAST в Кавендишской лаборатории, которая возглавила исследование.
«То, что мы наблюдали такие резкие изменения на начальной стадии диффузии реакции, было remarkable. Это заставило нас задуматься: есть ли какой-либо другой фундаментальный процесс, который подвержен таким изменениям? Какие другие механизмы реакции мы можем раскрыть?»
Исследовательская группа теперь планирует расширить свое моделирование, включив другие виды, такие как ионы натрия, хлорида и карбоната, которых много в океанах Земли. Это добавит дополнительный уровень реализма их симуляциям, способствуя более точному прогнозированию тенденций pH и поверхностной реакционной способности.
Больше информации: Samuel G. H. Brookes et al, CO2 hydration at the air–water interface: A surface-mediated "in-and-out" mechanism, Proceedings of the National Academy of Sciences (2025). DOI: 10.1073/pnas.2502684122
Источник: University of Cambridge











0 комментариев