Учёные расшифровали реакционный цикл фермента для фиксации CO₂ с помощью криоэлектронной микроскопии
Профессор Петра Вендлер и доктор Якоб Руикхольдт при подготовке держателя образца для криоэлектронной микроскопии. Автор: Софи Райсдорф
Криоэлектронная микроскопия высокого разрешения позволяет детально изучать сложные ферментативные процессы. С помощью этого метода исследовательской группе из Потсдамского университета и Университета имени Гумбольдта в Берлине удалось детально охарактеризовать ферментный комплекс CODH/ACS. Учёные обнаружили, что комплекс перемещается в ходе химических реакций, определяя их последовательность. Результаты исследования опубликованы в журнале Nature Catalysis.
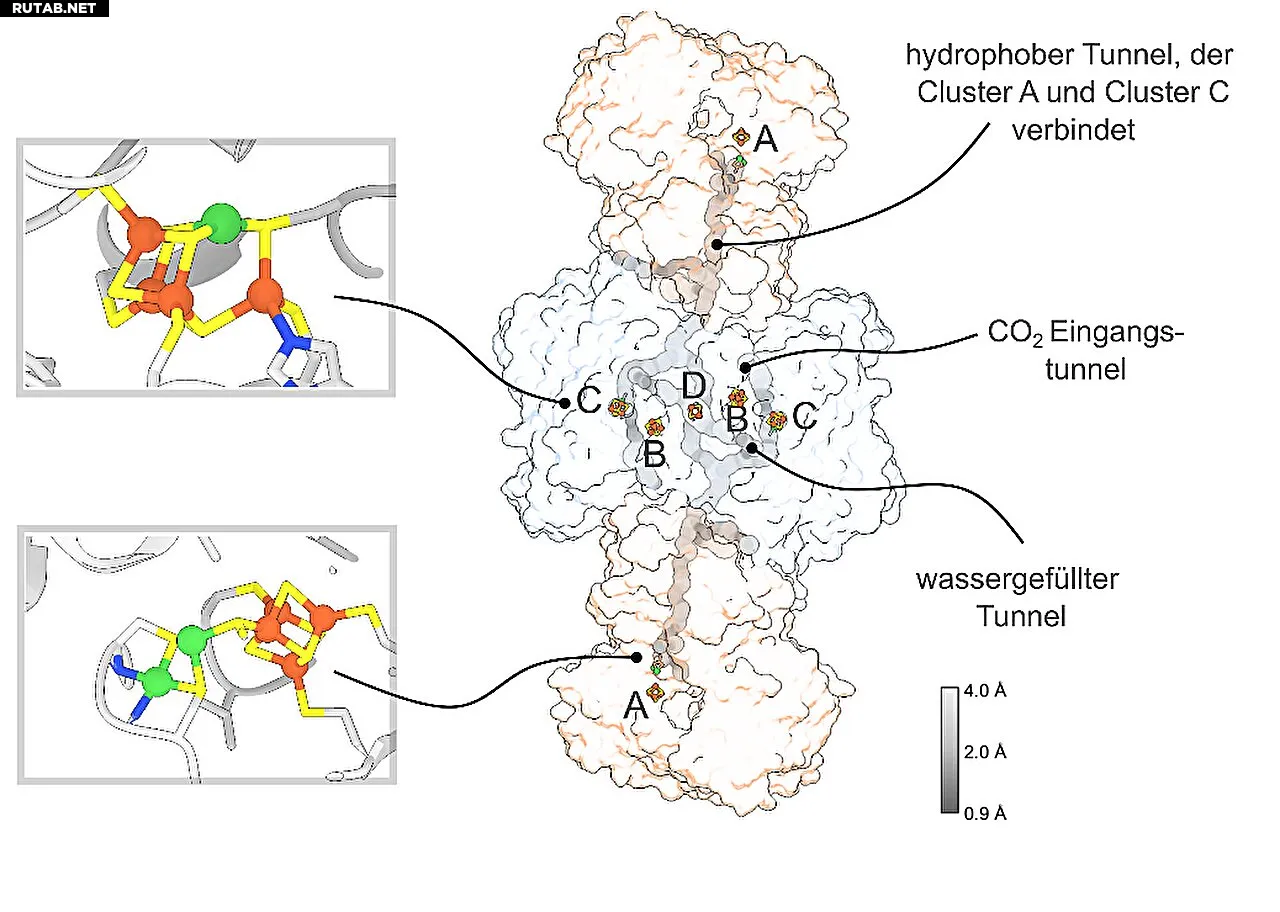
До появления фотосинтеза в истории Земли и накопления кислорода в атмосфере здесь существовали анаэробные микроорганизмы, не нуждающиеся в кислороде для метаболизма. Анаэробная фиксация углерода считается одним из древнейших и наиболее эффективных процессов своего рода и играет ключевую роль в современных экосистемах — например, в вулканических болотах или пищеварительном тракте животных. Ферментный комплекс CO-дегидрогеназа-ацетил-КоА-синтаза (CODH/ACS), необходимый для этого процесса, сохраняется в микроорганизмах уже более 3,5 миллиардов лет.
Катализ (ускорение химических процессов в CODH/ACS) основан на различных никель-железных металлокластерах, которые преобразуют углекислый газ в важную биомолекулу ацетил-КоА за несколько стадий. Эффективность этой реакции делает CODH/ACS перспективным кандидатом для производства биотоплива из углекислого газа.
Исследователи впервые применили криоэлектронную микроскопию высокого разрешения (крио-ЭМ) для изучения каталитического цикла CODH/ACS. Этот метод имеет широкий спектр применения и может использоваться для структурного анализа различных ферментов и биополимеров.
Обзор комплекса CODH/ACS. Восстановление CO₂ до CO происходит в кластере C (C). Оттуда CO мигрирует через гидрофобный туннель к кластеру A (A), где происходит фиксация углерода. Промежуточный CO реагирует там с метильной группой и коферментом A с образованием ацетил-КоА. Автор: Якоб Руикхольдт
«Наши крио-ЭМ карты шести промежуточных состояний CODH/ACS настолько высокого разрешения, что молекулы, связанные с металлическим центром, можно чётко соотнести с движениями белка», — говорит Якоб Руикхольдт, ведущий автор исследования.
«Различные состояния связывания CODH/ACS ранее не исследовались с помощью крио-ЭМ», — отмечает Петра Вендлер.
Доктор Якоб Руикхольдт при переносе образцов в держатель. Фото: Софи Райсдорф. Автор: Софи Райсдорф
«Используя этот метод, мы обнаружили, как связывание различных молекул подготавливает активный центр для следующего этапа реакции, предотвращая побочные реакции и потерю ценных промежуточных продуктов. Эти знания помогут использовать катализ древнего ферментного комплекса для биотехнологической фиксации углерода».
Дополнительная информация: Jakob Ruickoldt et al, Ligand binding to a Ni–Fe cluster orchestrates conformational changes of the CO-dehydrogenase–acetyl-CoA synthase complex, Nature Catalysis (2025). DOI: 10.1038/s41929-025-01365-y
Источник: University of Potsdam















0 комментариев